Deuterium
- 1599
- 347
- Herbert Fritsch
Apa deuterium?
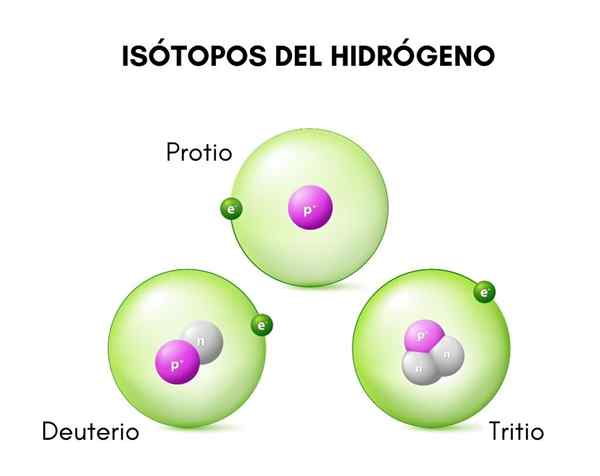
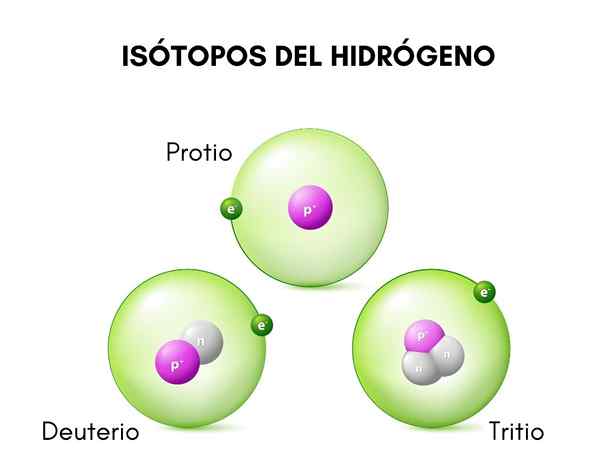
Dia deuterium Ini adalah salah satu spesies isotop hidrogen, yang direpresentasikan sebagai d atau 2H. Selain itu, nama hidrogen berat telah diberikan, karena massanya dua kali lipat dari proton. Isotop adalah spesies yang berasal dari elemen kimia yang sama, tetapi jumlah massa yang berbeda dari ini.
Perbedaan ini disebabkan oleh perbedaan dalam jumlah neutron yang dimilikinya. Deuterium dianggap sebagai isotop yang stabil dan dapat ditemukan dalam senyawa yang dibentuk oleh hidrogen asal alami, meskipun dalam proporsi yang cukup kecil (kurang dari 0,02 %).
Mengingat sifatnya, sangat mirip dengan hidrogen biasa, ia dapat menggantikan hidrogen dalam semua reaksi di mana ia berpartisipasi, menjadi zat yang setara.
Untuk alasan ini dan lainnya, isotop ini memiliki banyak aplikasi di berbagai bidang sains, menjadi salah satu yang paling penting.
Struktur deuterium
Struktur deuterium terutama dibentuk oleh inti yang memiliki proton dan neutron, dengan berat atom atau massa sekitar 2.014 g.
Demikian pula, isotop ini berutang penemuannya kepada Harold C. Urey, seorang ahli kimia dari Amerika Serikat, dan kolaboratornya Ferdinand Brickwedde dan George Murphy, pada tahun 1931.

Pada gambar atas Anda dapat melihat perbandingan antara struktur isotop hidrogen, yang ada dalam bentuk protio (isotopnya yang paling melimpah), deuterium dan tritium, dipesan dari kiri ke kanan.
Persiapan deuterium dalam keadaan murni dilakukan dengan sukses untuk pertama kalinya pada tahun 1933, tetapi sejak tahun 1950 -an zat fase padat telah digunakan dan yang telah menunjukkan stabilitas, yang disebut lithium deuteride (tutup), untuk menggantikan deuterium dan tritium di dalam sejumlah besar reaksi kimia.
Dapat melayani Anda: klorin oksida (iii): sifat, struktur, penggunaanDalam hal ini, kelimpahan isotop ini telah dipelajari dan telah diamati bahwa proporsinya di dalam air dapat sedikit berbeda, tergantung pada sumber dari mana sampel diambil.
Selain itu, melalui studi spektroskopi keberadaan isotop ini di planet lain dari galaksi ini telah ditentukan.
Beberapa data tentang deuterium
Perbedaan mendasar antara isotop hidrogen (yang merupakan satu -satunya yang telah dinamai dengan cara yang berbeda) terletak pada strukturnya, karena jumlah proton dan neutron dari suatu spesies memberikan sifat kimianya.
Di sisi lain, deuterium yang ada di dalam tubuh bintang dihilangkan dengan kecepatan yang lebih cepat dari yang berasal.
Selain itu, dianggap bahwa fenomena alam lain hanya membentuk jumlah yang sangat kecil, sehingga produksinya terus menghasilkan minat saat ini.
Demikian pula, serangkaian investigasi telah mengungkapkan bahwa sebagian besar atom yang telah terbentuk dari spesies ini berasal dari Big Bang; Inilah alasan mengapa kehadirannya di planet -planet besar seperti Jupiter diperingatkan.
Sebagai cara paling umum untuk mencapai spesies ini di alam adalah ketika dikombinasikan dengan hidrogen dalam bentuk pratio, minat komunitas ilmiah masih dibangunkan oleh hubungan yang ditetapkan antara proporsi kedua spesies di berbagai bidang ilmu pengetahuan, seperti itu sebagai astronomi atau cuaca.
Dapat melayani Anda: renio: penemuan, sifat, struktur, penggunaanSifat deuterium
- Ini adalah isotop yang tidak memiliki karakteristik radioaktif; Artinya, itu cukup stabil.
- Ini dapat digunakan untuk mengganti atom hidrogen dalam reaksi kimia.
- Spesies ini memanifestasikan perilaku selain hidrogen biasa dalam reaksi biokimia.
- Ketika dua atom hidrogen diganti dalam air, D diperoleh2Atau, memperoleh nama air tebal.
- Hidrogen yang ada di lautan yang ada dalam bentuk deuterium ada dalam proporsi 0,016 % dalam kaitannya dengan pratio.
- Di bintang -bintang, isotop ini memiliki kecenderungan untuk menyatu dengan cepat untuk menimbulkan helium.
- D2Atau merupakan spesies beracun, meskipun sifat kimianya sangat mirip dengan Her2
- Ketika atom deuterium mengalami proses fusi nuklir pada suhu tinggi, detasemen energi dalam jumlah besar diperoleh.
- Sifat fisik seperti titik didih, kepadatan, panas penguapan, triple point, antara lain, memiliki besaran utama dalam molekul deuterium (D2) bahwa dalam hidrogen (h2).
- Cara paling umum di mana ia ditemukan terkait dengan atom hidrogen, menyebabkan hidrogen deuterida (HD).
Penggunaan/Aplikasi
Karena sifatnya, deuterium digunakan dalam berbagai aplikasi di mana hidrogen terlibat. Beberapa dari penggunaan ini dijelaskan di bawah ini:
- Di bidang biokimia itu digunakan dalam penandaan isotop, yang terdiri dari "menandai" sampel dengan isotop yang dipilih untuk melacaknya melalui bagiannya melalui sistem yang diberikan.
Dapat melayani Anda: asam kuat- Dalam reaktor nuklir yang melakukan reaksi fusi, digunakan untuk mengurangi kecepatan neutron bergerak tanpa penyerapan tinggi dari ini yang dihadirkan oleh hidrogen biasa.
- Di area resonansi magnetik nuklir (NMR), pelarut berdasarkan deuterium digunakan untuk mendapatkan sampel dari jenis spektroskopi ini tanpa adanya gangguan yang dihasilkan dengan menggunakan pelarut terhidrogenasi.
- Di bidang biologi, makromolekul dipelajari melalui teknik dispersi neutron, di mana sampel yang disediakan dengan deuterium digunakan untuk secara signifikan mengurangi kebisingan dalam sifat kontras ini.
- Di area farmakologi, penggantian hidrogen digunakan oleh deuterium dengan efek isotop kinetik yang dihasilkan dan memungkinkan obat -obatan ini memiliki setengah kehidupan yang lebih lama.