Struktur Diklorometana, Sifat, Penggunaan, Toksisitas

- 5060
- 1149
- Miss Marion Graham
Dia Diklorometana, Juga dikenal sebagai methylene chloride, itu adalah senyawa organik yang formula kimianya adalah ch2Cl2. Secara khusus, ini adalah alkil halogenida yang berasal dari gas metana. Tidak seperti metana, senyawa ini adalah cairan yang tidak berwarna dan kutub.
Awalnya disintesis pada tahun 1839 oleh ahli kimia dan ahli fisika Prancis Henri Victor Regnault (1810-1878), yang berhasil mengisolasinya dari campuran klorin dan klorometana yang terpapar sinar matahari pada sinar matahari.
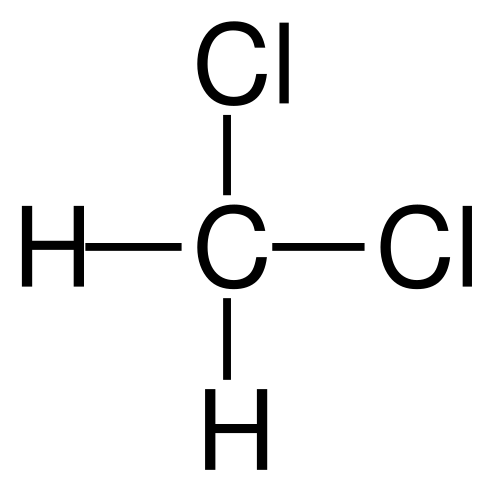 Formula struktural diklorometana. Sumber: Jü [domain publik]
Formula struktural diklorometana. Sumber: Jü [domain publik] Dichloromethane terjadi secara industri dengan pengobatan metana atau kloroman dengan gas klor pada suhu tinggi (400-500 ºC). Bersama dengan diklorometana, mereka terjadi dalam proses kloroform dan karbon tetrachloride, yang dipisahkan oleh distilasi.
Dichloromethane digunakan sebagai pelarut yang memungkinkan pengelasan bahan plastik dan untuk menurunkan logam. Ini juga digunakan dalam kopi dan teh decaffein.
Diklorometana adalah senyawa beracun yang dapat menghasilkan dengan iritasi inhalasi lubang hidung dan tenggorokan. Kerusakan hati telah dilaporkan pada pekerja yang terpapar ke konsentrasi tinggi diklorometana. Selain itu, ia adalah agen mutagenik, dicurigai sebagai karsinogenik.
[TOC]
Struktur
 Struktur molekul diklorometana. Sumber: Gabriel Bolívar via Molview.
Struktur molekul diklorometana. Sumber: Gabriel Bolívar via Molview. Pada gambar pertama formula struktural CH ditampilkan2Cl2, di mana ikatan kovalen mereka C-H dan C-CL menonjol. Naik dan strukturnya diwakili oleh model bola dan batang. Catatan sekilas bahwa ikatan C-H (bola putih) pendek, sedangkan ikatan C-CL (bola hijau) sudah lama.
Cho Geometry2Cl2 Itu tetrahedral; tetapi terdistorsi karena atom klorin yang paling besar. Salah satu ujung tetrahedron ditentukan oleh dua atom klorin, lebih elektronegatif daripada hidrogen dan karbon. Oleh karena itu, dalam molekul ch2Cl2 momen dipol permanen ditetapkan (1.6d).
Dapat melayani Anda: reaksi netralisasiIni memungkinkan molekul diklorometana untuk berinteraksi satu sama lain melalui gaya dipol-dipolo. Demikian juga, interaksi antarmolekul ini bertanggung jawab atas senyawa ini ada sebagai cairan meskipun massa molekulnya rendah; Cairan yang, bagaimanapun, cukup fluktuatif.
Properti
Penampilan
Cairan tidak berwarna.
Masa molar
84.93 g/mol.
Bau
Manis, mirip dengan kloroform.
Ambang bau
205 - 307 ppm.
Kepadatan
1.3266 g/cm3 (20 ºC).
Titik lebur
- 97.6 ºC.
Titik didih
39.6 ºC.
Kelarutan air
25,6 g/L pada 15 ºC dan 5,2 g/L A 60 ºC.
Diklorometana hampir tidak larut dalam air. Sedangkan kedua molekul, cho2Cl2 dan H2Atau, mereka kutub, interaksinya mungkin tidak efisien karena tolakan antara klorin dan atom oksigen.
Kelarutan dalam pelarut lain
Dilarang dengan etil asetat, alkohol, heksana, benzena, karbon tetraklorida, dialetl eter, kloroform dan dimetilformamide.
Koefisien Partisi Octanol/Air
Log p = 1.19.
Tekanan uap
57,3 kPa (25 ºC). Tekanan ini sesuai dengan sekitar 5,66 atm, mencerminkan tekanan uap yang tinggi.
Kepadatan uap
2.93 dalam hubungan udara diambil sebagai 1.
Indeks refraksi (πd)
1.4244 (20 ºC).
Zat yang lengket dan kental
0,413 cp (25 ºC).
titik pengapian
Dichloromethane tidak mudah terbakar, tetapi ketika dicampur dengan udara itu membentuk uap yang mudah terbakar di atas 100 ºC.
Suhu self -rection
556 ºC.
Stabilitas
Stabil pada suhu sekitar tanpa adanya kelembaban, memiliki stabilitas relatif bila dibandingkan dengan congenernya: karbon tetraklorida kloroform dan tetrachloride.
Ini cenderung berkarbonisasi pada suhu tinggi (300-450 ºC), saat uapnya bersentuhan dengan baja dan logam klorida.
Penguraian
Ini dapat dipecah menjadi kontak dengan permukaan panas atau nyala api, memancarkan uap phosgen dan hidrogen klorida yang beracun dan mengiritasi dan mengiritasi.
Dapat melayani Anda: elektron diferensialKorosi
Dichloromethane menyerang beberapa bentuk plastik, karet, dan pelapis.
Panas penguapan
28.82 kJ/mol A 25 ºC.
Tegangan permukaan
28.20 dynas/cm pada 25 ºC.
Reaktivitas
Dichloromethane bereaksi kuat dengan logam aktif, seperti kalium, natrium dan lithium. Bereaksi dengan basis yang kuat, misalnya, kalium bouthexide. Ini tidak sesuai dengan zat kaustik, oksidan dan logam aktif kimia.
Selain itu, bereaksi dengan oksigen cair dalam sodium dan paduan kalium dan nitrogen tetroksida. Kontak dengan air Anda dapat menjalankan baja tahan karat, nikel, tembaga, serta besi.
Aplikasi
Sebagian besar penggunaan dan aplikasi diklorometana didasarkan pada sifatnya sebagai pelarut. Karena karakteristik ini, diklorometana digunakan dalam makanan, transportasi, industri produksi obat, dll.
Pengolahan makanan
Dichloromethane digunakan dalam biji -bijian kopi dan daun teh tanpa kafein. Ini juga digunakan untuk ekstraksi hop untuk bir, minuman dan bendera makanan lainnya, serta untuk pemrosesan rempah -rempah.
Industri farmasi
Diklorometana digunakan untuk persiapan sefalosporin dan ampisilin, selain pembuatan antibiotik, steroid dan vitamin.
Fotografi
Ini juga digunakan sebagai pelarut dalam produksi selulosa triasetat (CTA), yang digunakan dalam pembuatan film keamanan.
Industri elektronik
Ini adalah senyawa yang ideal untuk produksi pelat sirkuit cetak, menggunakan permukaan aluminium sebelum menambahkan fotoret pelat.
Cat
Diklorometana adalah pelarut yang ditemukan dalam pernis dan pemisah cat, digunakan untuk menghilangkan pernis atau lapisan lukisan dari berbagai jenis permukaan.
Mengangkut
Ini berfungsi untuk menurunkan bagian dan permukaan logam yang ada dalam peralatan kereta api, serta komponen pesawat terbang.
Dapat melayani Anda: air sulingPenggunaan lainnya
Ini digunakan sebagai propelan semprotan (aerosol) dan sebagai agen ekspansi untuk busa poliuretan. Ini juga digunakan sebagai cairan di beberapa jenis lampu Natal.
Toksisitas
Efek akut
Penghirupan diklorometana dapat menyebabkan iritasi saluran udara atas, batuk, mengi atau kurangnya udara.
Itu dapat menghasilkan kemerahan kulit, dan jika senyawa tetap lama di atasnya, menyebabkan luka bakar kimia. Bersentuhan dengan mata, diklorometana menghasilkan iritasi parah yang dapat memanjang ke luka bakar.
Selain itu, ia bertindak sebagai perubahan visual, pendengaran, dan psikomotorik yang menghasilkan neurotoksin; Tetapi efek ini dapat dibalikkan untuk menghentikan inhalasi diklorometana.
Efek kronis
Diklorometana dapat mempengaruhi sistem saraf pusat dan menghasilkan sakit kepala, kebingungan mental, mual, muntah dan kehilangan memori.
Pada hewan itu menghasilkan efek berbahaya pada hati, ginjal, sistem saraf pusat dan sistem kardiovaskular.
Segera setelah karsinogenesis belum melaporkan peningkatan yang signifikan dalam kematian kanker pada pekerja yang terpapar diklorometana. Namun, penelitian pada hewan telah menunjukkan peningkatan yang disebabkan oleh diklorometana dalam kejadian kanker hati dan paru -paru, serta tumor jinak dari kelenjar susu.
Referensi
- Morrison, r. T. dan boyd, r, n. (1987). Kimia organik. 5ta Edisi. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (10th Edisi.). Wiley Plus.
- Pusat Nasional Informasi Bioteknologi. (2020). Diklorometana. Database pubchem., CID = 6344. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Wikipedia. (2020). Diklorometana. Diperoleh dari: di.Wikipedia.org
- Brumer. (14 Juli 2018). Diklorometana. Pulih dari: brumer.com
- MSDS Online. (2019). Dichloromethane (Methylene Chloride) Bahaya & Informasi Keselamatan. Diperoleh dari: msdsonline.com
- EPA. (2000). Methylene chloride (diklorometana). [PDF]. Pulih dari: EPA.Pemerintah

