Struktur dimethylamine ((CH3) 2NH), sifat, penggunaan, risiko
- 3550
- 383
- Miss Marion Graham
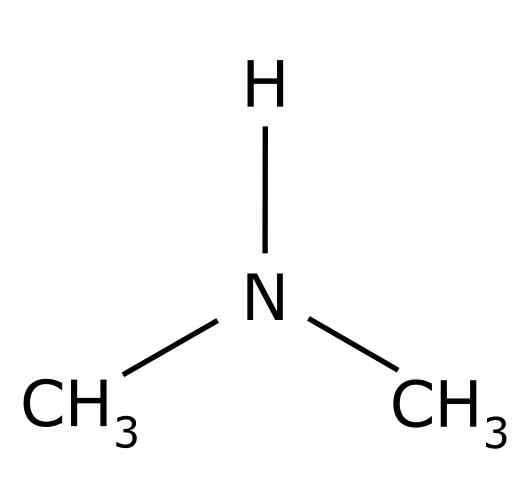
Itu dimethylamine Ini adalah senyawa organik yang dibentuk oleh dua kelompok metil -ch3 Bersatu dengan grup -nh. Formula kimianya adalah (cho3)2NH. Itu adalah gas yang tidak berwarna. Saat bau ikan dirasakan di udara dengan konsentrasi rendah. Namun, jika dalam konsentrasi tinggi, ia memiliki aroma amonia NH3.
Dimethylamine hadir pada tumbuhan dan hewan. Dipercayai bahwa pada manusia berasal dari dekomposisi enzim tertentu tetapi juga dari konsumsi beberapa makanan seperti ikan. Jika gas dimethylamine larut dalam air, ia membentuk larutan yang sangat basa dan korosif.
 Dimethylamine. Ring0 [domain publik]. Sumber: Wikimedia Commons.
Dimethylamine. Ring0 [domain publik]. Sumber: Wikimedia Commons. Ini memiliki berbagai kegunaan industri seperti menghasilkan pelarut, untuk mempercepat vulkanisasi karet.
Dimetilamine adalah gas yang sangat mudah terbakar. Wadah yang mengandungnya tidak boleh terpapar panas atau api seperti yang dapat dieksploitasi. Selain itu, uapnya mengiritasi mata, kulit, dan saluran pernapasan.
Ini adalah senyawa yang bisa menjadi bagian dari aerosol atmosfer, yaitu, tetesan yang sangat tipis yang ditemukan di atmosfer.
[TOC]
Struktur
Dimetilamine adalah amina alifatik sekunder. Ini berarti bahwa substituen nitrogen (n) adalah alifatik (-ch3), yang berarti bahwa mereka tidak aromatik, dan mereka adalah dua. Oleh karena itu ada dua metil -ch3 United Nitrogen, yang juga memiliki hidrogen (H).
Dalam molekul dimethylamine, nitrogen (N) memiliki sepasang elektron bebas, yaitu, beberapa elektron yang tidak disatukan dengan atom lainnya.
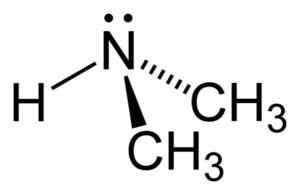 Struktur dimethylamine. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons.
Struktur dimethylamine. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons. Tata nama
- Dimethylamine
- N, n-dimethylamine
- N-methylmetanamine
- DMA (akronim untuk Di-Methyl-Amine).
Properti
Keadaan fisik
Gas tidak berwarna.
Berat molekul
45,08 g/mol
Titik lebur
-93 ºC
Titik didih
7.3 ºC
Titik nyala
-6.69 ºC (metode cangkir tertutup).
Suhu self -rection
400 ° C
Dapat melayani Anda: hukum berbagai proporsiKepadatan
Cairan = 0,6804 g/cm3 A 0 ºC.
Uap = 1.6 (kepadatan relatif sehubungan dengan udara, udara = 1).
Kelarutan
Sangat larut dalam air: 163 g/100 g air pada suhu 40 ° C. Larut dalam etanol dan etil eter.
ph
Larutan dimethylamine berair sangat basa.
Konstan disosiasi
KB = 5.4 x 10-4
Pkke asam terkonjugasi = 10.732 hingga 25 ° C. Asam konjugat adalah ion dimethylamonium: (Cho3) Nh2+
Sifat kimia
Dimethylamine cair dapat menyerang beberapa plastik, ban dan lapisan.
Saat larut dalam air, pasangan elektron bebas nitrogen (N) mengambil proton (h+) air, meninggalkan oh bebas-, Jadi itu membentuk solusi yang sangat basa dan korosif:
Dimethylamine + air → ion dimethylamonium + ion hidroksil
(Ch3)2NH + H2O → (pilih3)2NH2+ + Oh-
Dengan asam nitrat, garam nitrat diperoleh, yaitu, dimethyla amotylamonium nitrat:
Dimethylamine + asam nitrat → dimethylamonium nitrate
(Ch3)2NH +HNO3 → (Ch3)2NH2+TIDAK3-
Properti lainnya
Ketika dalam konsentrasi udara rendah memiliki bau yang mirip dengan ikan, sedangkan dalam konsentrasi tinggi baunya seperti amonia (NH3).
Reaksi biokimia
Dalam organisme, dimethylamine dapat menderita nitrillary di bawah kondisi asam yang lemah untuk memberikan dimethylnitrosamine senyawa karsinogen (CH3)2N-no.
Formasi dimetlnitrosamin terjadi dari dimethylamine dan nitrit (natrium nitrit) di lambung (pH 5-6) dengan aksi bakteri yang ada di saluran gastrointestinal. Sodium nitrit hadir dalam beberapa makanan.
Dimethylamine + natrium nitrit → dimethylnitrosamine + natrium hidroksida
(Ch3)2NH + Nano2 → (Ch3)2N-no + naOH
Memperoleh
Dimetilamine disiapkan secara komersial dengan bereaksi metanol (pilih3Oh) dengan amonia (NH3) pada 350-450 ° C di hadapan katalis silika-alumina (SIO2/Ke2SALAH SATU3).
2 ch3Oh + nh3 → (Ch3)2NH + 2 H2SALAH SATU
Karena monomethylamine dan trimethylamine juga diproduksi, pemurnian dilakukan dalam serangkaian empat hingga lima kolom distilasi.
Kehadiran di alam
Dimethylamine ditemukan pada tumbuhan dan hewan. Ini juga hadir secara alami dan berlimpah dalam urin manusia.
Ini dapat melayani Anda: Epoxide: Nomenklatur, Perolehan, Aplikasi, ContohDiperkirakan bahwa kehadirannya pada manusia disebabkan oleh fakta bahwa jenis bakteri usus tertentu diproduksi dari beberapa senyawa yang ditemukan dalam makanan.
Beberapa senyawa ini adalah bukit (senyawa yang berhubungan dengan kelompok vitamin B) dan trimethylamine oxide. Dipercayai juga berasal dari inhibitor enzim oksida nitrat (NO) yang terbentuk di dalam tubuh.
Sumber informasi tertentu menunjukkan bahwa peningkatan dimetilamin dalam urin disebabkan oleh konsumsi ikan dan buah -buahan laut, di mana nilai -nilai utama diperoleh ketika mereka makan cumi -cumi, hake, sarden, ikan pedang, ikan kod, ikan dan garis.
 Makan ikan bisa meningkatkan kadar dimethylamine dalam urin. Penulis: Anna Sulencha. Sumber: Pixabay.
Makan ikan bisa meningkatkan kadar dimethylamine dalam urin. Penulis: Anna Sulencha. Sumber: Pixabay. Pasien dengan dimethylamine berlebih
Dianggap bahwa dimethylamine adalah toksin uremik, yaitu zat yang dapat menyebabkan kerusakan jika konsentrasinya dalam urin dinaikkan. Faktanya, kadar dimethylamine yang sangat tinggi telah diamati pada pasien dengan penyakit ginjal pada tahap terminal.
Dipercayai bahwa pada pasien ini mungkin ada kelebihan populasi bakteri usus yang bisa memproduksinya.
Aplikasi
DMA atau DMA digunakan untuk:
- Persiapan senyawa lain.
- Produksi pelarut dimethylformamide dan dimethylacetamide.
- Mempercepat vulkanisasi gusi tertentu.
- Menghilangkan rambut rambut saat penyamakan.
- Bertindak sebagai antioksidan untuk pelarut.
- Sajikan sebagai agen pengapungan mineral.
- Menghambat korosi dan sebagai agen anti -sniff.
- Berfungsi sebagai surfaktan.
- Membuat sabun dan deterjen.
- Bertindak sebagai ahli kimia dalam tekstil.
- Fungsi sebagai agen anti -penanggalan dalam bahan bakar dan sebagai penstabil gas.
- Siapkan pewarna.
- Menyerap gas asam.
- Berfungsi sebagai pestisida dan roket.
- Menjadi bagian dari agen untuk pengolahan air.
- Bertindak sebagai fungisida dalam produk agrokimia.
- Sudah dihentikan penggunaan seperti menarik dan memusnahkan gorgjo atau serangga yang menyerang kapas.
 Tanaman kapas. Penulis: Isaa KC. Sumber: Pixabay.
Tanaman kapas. Penulis: Isaa KC. Sumber: Pixabay.  Di masa lalu serangga yang menyerang tanaman kapas dieliminasi dengan dimethylamine. Marvinbikolano [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Di masa lalu serangga yang menyerang tanaman kapas dieliminasi dengan dimethylamine. Marvinbikolano [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Risiko
Uap dimetilamin adalah kulit yang mengiritasi, mata, dan saluran pernapasan.
Dapat melayani Anda: senyawa anorganikJika Anda bersentuhan dengan kulit dalam bentuk cair dapat menyebabkan pembekuan dan pembakaran bahan kimia. Inhalasinya memiliki efek kesehatan yang merugikan.
Gas DMA bersifat korosif dan dapat membentuk larutan berair korosif. Solusi berair Anda bisa menjadi mudah terbakar kecuali mereka cukup encer.
Dimethylamine berbentuk gas mudah meradang dengan menghasilkan asap beracun nitrogen oksida (NOX).
Jika wadah yang mengandung gas ini terpapar panas atau panas yang intens, ia dapat meledak.
Pengaruh DMA di atmosfer
Aerosol atmosfer (tetesan yang sangat kecil dari campuran senyawa alami dan/atau polutan di atmosfer) memiliki dampak yang mendalam pada iklim global dan kualitas udara di berbagai daerah di dunia.
Pembentukan partikel aerosol baru belum sepenuhnya dipahami.
Diperkirakan bahwa dimethylamine berpartisipasi bersama dengan senyawa lain dalam pembentukan partikel -partikel ini, yang tampaknya tergantung pada area emisi DMA yang kuat.
Misalnya, di kawasan industri ada konsentrasi yang lebih besar daripada di daerah pertanian, dan ini dapat mempengaruhi cara DMA berpartisipasi.
Perlu dicatat bahwa, menurut beberapa ilmuwan, pembakaran bahan tanaman yang mengandung glifosat (salah satu herbisida yang paling banyak digunakan di dunia) dapat menyebabkan pembentukan dimetilamin.
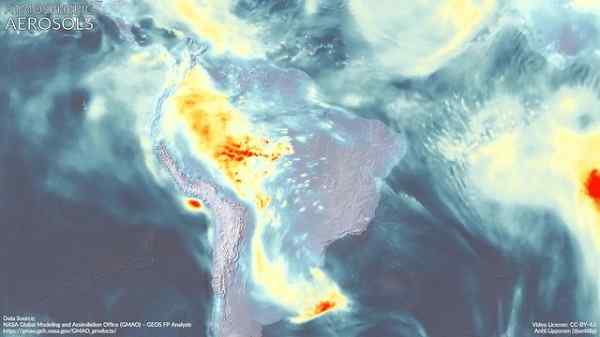 Aerosol atmosfer di Amerika Selatan. Dimetilamine dapat berkontribusi pada pembentukannya. Marvinbikolano [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Aerosol atmosfer di Amerika Selatan. Dimetilamine dapat berkontribusi pada pembentukannya. Marvinbikolano [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Dimethylamine. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Edisi keempat. John Wiley & Sons.
- Morrison, r.T. dan Boyd, R.N. (2002). Kimia organik. Edisi ke -6. Prentice-Hall.
- Windholz, m. et al. (Editor) (1983). Indeks Merck. Eneritedia bahan kimia, obat -obatan, dan biologis. Edisi kesepuluh. Merck & Co., Inc.
- Abramowitz, m.K. et al. (2010). Patofisiologi uremia. Amina alifatik. Pada penyakit ginjal kronis, dialisis, dan transplantasi (edisi ketiga). Pulih dari scientedirect.com.
- Li, h. et al. (2019). Pengaruh kondisi atmosfer pada pembentukan partikel baru berbasis asam-dimethylamine-ammonia. Chospher 2019; 245: 125554. NCBI pulih.Nlm.Nih.Pemerintah.
- Mackie, J.C. dan Kennedy, dan.M. (2019). Pirolisis glifosat dan lagu -lagu produk beracun. Lingkungan. Sci. Technol. 2019: 53 (23): 13742-13747. NCBI pulih.Nlm.Nih.Pemerintah.

