Bagian dan contoh persamaan kimia
- 4328
- 514
- Domingo Gutkowski
Itu Persamaan kimia Ini adalah representasi skematik dari beberapa karakteristik reaksi kimia. Dapat juga dikatakan bahwa persamaan kimia menggambarkan perubahan yang dialami oleh berbagai zat yang terlibat dalam suatu reaksi.
Dalam persamaan kimia, rumus dan simbol zat yang berpartisipasi ditempatkan, dengan jelas menunjukkan jumlah atom dari setiap elemen yang ada dalam senyawa, yang muncul sebagai subskrip dan tidak dapat diubah saat menyeimbangkan persamaan.
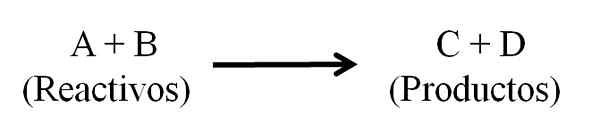
 Persamaan Kimia Umum untuk Reaksi Kimia. Reagen dan produk. Sumber: Gabriel Bolívar.
Persamaan Kimia Umum untuk Reaksi Kimia. Reagen dan produk. Sumber: Gabriel Bolívar. Persamaan kimia harus tampak seimbang, yaitu, jumlah atom dari kedua reagen dan produk harus sama. Dengan cara ini hukum konservasi materi dipatuhi. Diinginkan bahwa angka yang digunakan untuk menyeimbangkan persamaan adalah bilangan bulat.
Persamaan ini tidak mengungkapkan langkah -langkah berturut -turut, atau mengapa reagen mekanisme diubah menjadi produk.
Itulah sebabnya meskipun mereka sangat berguna untuk memahami ke mana arah reaksi kimia, itu tidak memungkinkan untuk memahami aspek molekulernya atau bagaimana mereka dipengaruhi oleh variabel tertentu; seperti pH, viskositas, waktu reaksi, kecepatan agitasi, antara lain.
[TOC]
Bagian dari persamaan kimia
Pada dasarnya ada tiga bagian utama dalam persamaan kimia: reagen, produk dan panah yang menunjukkan makna reaksi kimia.
Lokasi Reagen dan Produk
Dalam persamaan kimia semua zat yang berfungsi sebagai reagen dan semua yang muncul produk. Kelompok zat ini dipisahkan oleh panah yang menunjukkan makna reaksi. Reagen terletak di sebelah kiri panah dan produk di sebelah kanan.
Panah berarti apa yang diproduksi dan berorientasi dari kiri ke kanan (→), meskipun dalam reaksi reversibel ada dua panah yang setara dan paralel; satu diarahkan ke kanan, dan yang lain ke kiri. Simbol (Δ) biasanya ditempatkan pada panah, menunjukkan bahwa panas digunakan dalam reaksi.
Dapat melayani Anda: terpenosSelain itu, identifikasi katalis biasanya ditempatkan pada panah, jika memungkinkan dengan formula atau simbolnya. Zat yang berbeda yang muncul sebagai reagen dipisahkan oleh tanda (+), menunjukkan bahwa zat bereaksi atau bergabung satu sama lain.
Dalam kasus zat yang muncul sebagai produk, tanda (+) tidak memiliki konotasi sebelumnya; Kecuali reaksinya reversibel. Lebih mudah bahwa tanda (+) ditempatkan sama dari zat yang terpisah.
Keseimbangan persamaan kimia
Ini adalah persyaratan penting bahwa persamaan kimia seimbang dengan benar. Untuk ini, angka yang disebut koefisien stoikiometrik ditempatkan. Kapan pun diperlukan, koefisien ini harus berada di depan zat yang muncul sebagai reagen atau produk.
Ini adalah untuk memastikan bahwa jumlah semua atom dari elemen yang muncul sebagai reagen persis sama dengan jumlah mereka yang muncul dalam produk. Metode persamaan kimia paling sederhana adalah dari tanteo.
Keadaan fisik komponen persamaan kimia
Dalam beberapa persamaan kimia, keadaan fisik zat ditunjukkan dengan sub -industri. Untuk ini, singkatan berikut digunakan dalam bahasa Spanyol: (s) untuk keadaan solid; (l) untuk keadaan cair; (g), keadaan gas; dan (ac), larutan berair.
Contoh: Reaksi kalsium karbonat dengan asam klorida.
Maling3 (s) + 2 HCl(AC) → CACL2 (s) + H2SALAH SATU(L) + BERSAMA2 g)
Perubahan status fisik
Dalam beberapa kasus, diindikasikan dalam persamaan kimia jika ada produksi gas dalam reaksi kimia atau jika ada presipitasi dari salah satu zat yang diproduksi.
Dapat melayani Anda: garam binerKehadiran gas ditunjukkan dengan panah vertikal dengan ujungnya diarahkan ke atas (↑), ditempatkan di sisi kanan zat gas.
Contoh: Reaksi seng dengan asam klorida.
Zn +2 HCl → Zncl2 + H2↑
Jika dalam reaksi kimia, salah satu zat membentuk endapan, ini dilambangkan dengan menempatkan panah vertikal dengan ujungnya diarahkan ke bawah (↓), ditempatkan di sisi kanan zat yang diendapkan.
Contoh: Reaksi asam klorida dengan nitrat perak.
Hcl + Agno3 → Hno3 + AgCl ↓
Contoh Persamaan Kimia
- Fotosintesis
 Persamaan fotosintesis
Persamaan fotosintesis Fotosintesis adalah proses di mana tanaman menangkap dan mengubah energi cahaya, dari sinar matahari, untuk menghasilkan energi yang diperlukan untuk subsistennya. Fotosintesis dilakukan oleh organel yang khas dari sel tanaman yang disebut kloroplas.
Dalam membran kloroplas adalah tilacoids, tempat -tempat di mana klorofil ditemukan ke Dan B, yang merupakan pigmen utama yang menangkap energi cahaya.
Sementara fotosintesis adalah proses yang kompleks, ia dapat ditrempa dalam persamaan kimia berikut:
6 co2 + 6 h2O → c6H12SALAH SATU6 + 6 o2↑ ΔGº = 2.870 kJ/mol
C6H12SALAH SATU6 Ini adalah formula glukosa, karbohidrat teretabolisme untuk produksi ATP; Senyawa yang merupakan reservoir energi utama di sebagian besar makhluk hidup. Selain itu, dari glukosa NADPH dihasilkan, koenzim yang dibutuhkan untuk banyak reaksi.
- Napas seluler
Sel menggunakan oksigen untuk metabolisme berbagai zat yang ada dalam makanan yang tertelan. Sementara itu, ATP digunakan sebagai sumber energi dari kegiatan yang dilakukan oleh makhluk hidup, menghasilkan dalam proses ini karbon dan air dioksida.
Dapat melayani Anda: aluminium asetat (al (ch3coo) 3): struktur, sifat, penggunaanJika glukosa digunakan sebagai model zat yang dimetabolisme, pernapasan dapat ditrempa dengan persamaan kimia berikut:
C6H12SALAH SATU6 + 6 o2 → 6 co2 + 6 h2SALAH SATU
- Reaksi elemen umum
Reaksi dekomposisi
Senyawa atau senyawa memisahkan (N) yang dibentuk dengan atom -atomnya senyawa lain yang berbeda:
2 kclo3 (s) → 2 kcl(S) + 3 o2 g)
Reaksi perpindahan
Logam bereaksi dengan senyawa yang menggantikan logam yang ada dalam hal ini:
Mg(S) + Cuso4 (ac) → Cu(S) + Mgso4 (ac)
Reaksi eliminasi
Dalam jenis reaksi ini, jumlah atom atau kelompok yang melekat pada atom karbon:
Ch3-Ch2BR +NaOH → H2C = ch2 + H2O +NABR
Reaksi hidrasi
Itu adalah reaksi di mana suatu senyawa menambahkan molekul air. Reaksi ini penting dalam persiapan alkohol:
H2C = ch2 + H2O → h2C-ch2Oh
Reaksi netralisasi
Basa atau alkali bereaksi dengan asam yang menghasilkan garam dan air:
Hcl(AC) + Naoh(AC) → NaCl(AC) + H2SALAH SATU(L)
Reaksi sintesis
Dalam jenis reaksi ini dua atau lebih zat digabungkan untuk menyebabkan senyawa baru:
2 li(S) + Cl2 g) → 2 LICL(S)
Reaksi perpindahan ganda (metatesis)
Dalam jenis reaksi ini ada pertukaran ion positif dan negatif untuk membentuk senyawa baru:
Agno3 (ac) + NaCl(AC) → Agcl(S) + Kakak3 (ac)
Referensi
- Bunga, J. (2002). Kimia. Edisi 1dulu. Editorial Santillana
- Mathews, c. K., Van Holde, K. DAN., Dan Ahern, k. G. (2002). Biokimia. 3dulu Edisi. Editorial Pearson Addison Wesley
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Wikipedia. (2019). Persamaan kimia. Diperoleh dari: di.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (20 September 2019). Apa itu persamaan kimia? Pulih dari: thinkco.com
- « Konsep dan rumus volume molar, perhitungan dan contoh
- Formasi, Lokasi, Karakteristik Geologi Challenger Abyss »

