Elektron diferensial

- 1185
- 178
- Domingo Gutkowski
Dia elektron diferensial o Pembeda adalah elektron terakhir yang ditempatkan dalam urutan konfigurasi elektronik sebuah atom. Siapa namamu? Untuk menjawab pertanyaan ini, perlu mengetahui struktur dasar atom: inti, kekosongan dan elektron.
Nukleus adalah agregat yang padat dan kompak dari partikel positif yang disebut proton, dan partikel netral yang disebut neutron. Proton menentukan angka atom z dan, bersama dengan neutron, membentuk massa atom. Namun, sebuah atom tidak dapat membawa hanya tuduhan positif; Oleh karena itu elektron mengorbit di sekitar nukleus untuk menetralisirnya.
 Struktur atom dasar: partikel subatomik utama
Struktur atom dasar: partikel subatomik utama Dengan demikian, untuk setiap proton yang menambah nukleus, elektron baru dimasukkan ke dalam orbitalnya untuk menangkal muatan positif yang tumbuh. Dengan cara ini, elektron tambahan baru, elektron diferensial, terkait erat dengan angka atom z.
Elektron diferensial ditemukan di lapisan elektronik terluar: lapisan Valencia. Oleh karena itu, semakin lanjut nukleus, semakin besar energi yang terkait dengannya. Energi ini bertanggung jawab atas partisipasinya, serta hemat elektron Valencia lainnya, dalam karakteristik reaksi kimia dari unsur -unsur tersebut.
[TOC]
Angka kuantum
Seperti halnya elektron lainnya, elektron diferensial dapat diidentifikasi dengan empat angka kuantumnya. Tapi berapa angka kuantum? Mereka adalah "n", "l", "m" dan "s".
Angka kuantum "N" menunjukkan ukuran atom dan tingkat energi (k, l, m, n, atau, p, q). "L" adalah angka kuantum sekunder atau acemutal, yang menunjukkan bentuk orbital atom, dan mengambil nilai 0, 1, 2 dan 3 untuk orbital "s", "p", "d" dan "f ", masing -masing.
Itu dapat melayani Anda: Flask Aphorated: Karakteristik, untuk apa, tipe, penggunaan"M" adalah angka kuantum magnetik dan menunjukkan orientasi spasial orbital di bawah medan magnet. Jadi, 0 untuk orbital "S"; -1, 0, +1, untuk orbital "p"; -2, -1, 0, +1, +2, untuk orbital "D"; dan -3, -2, -1, 0, +1, +2, +3, untuk orbital "f". Akhirnya, jumlah kuantum putaran "S" (+1/2 untuk ↑, dan -1/2 untuk ↓).
Oleh karena itu, elektron diferensial telah mengaitkan angka kuantum sebelumnya ("n", "l", "m", "s"). Karena itu menangkal beban positif baru yang dihasilkan oleh proton tambahan, ini juga memberikan angka atom z dari elemen.
Bagaimana mengetahui diferensial elektron?
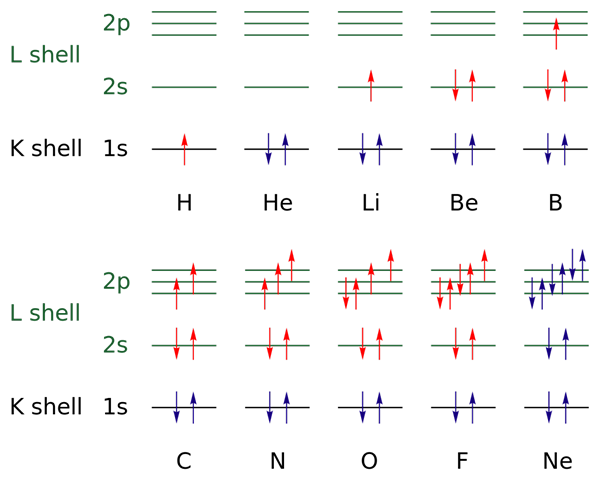
Pada gambar atas, konfigurasi elektronik diwakili untuk elemen dari hidrogen ke gas neon (H → NE).
Dalam hal ini, elektron lapisan terbuka ditunjukkan dengan warna merah, sedangkan lapisan tertutup ditunjukkan dengan warna biru. Lapisan mengacu pada angka kuantum "n", yang pertama dari empat.
Dengan cara ini, konfigurasi Valencia dari H (↑ dari merah) menambahkan elektron lain dengan orientasi yang berlawanan untuk menjadi HE (↓ ↑, keduanya biru karena sekarang level 1 ditutup). Elektron yang ditambahkan ini kemudian menjadi elektron diferensial.
Dengan demikian, dapat diamati bagaimana elektron diferensial menambah lapisan valensi (panah merah) dari elemen, membedakannya satu sama lain. Elektron mengisi orbital yang menghormati aturan wastafel dan prinsip pengecualian Pauling (diamati dengan sempurna dari B ke NE).
Dan bagaimana dengan angka kuantum? Ini menentukan setiap panah - yaitu, setiap elektron - dan nilainya dapat dikuatkan dengan konfigurasi elektronik untuk mengetahui apakah elektron diferensial atau tidak.
Itu dapat melayani Anda: apa efek negatif yang kami miliki dengan kelarutan air?Contoh elektron diferensial dalam beberapa elemen
Klorin
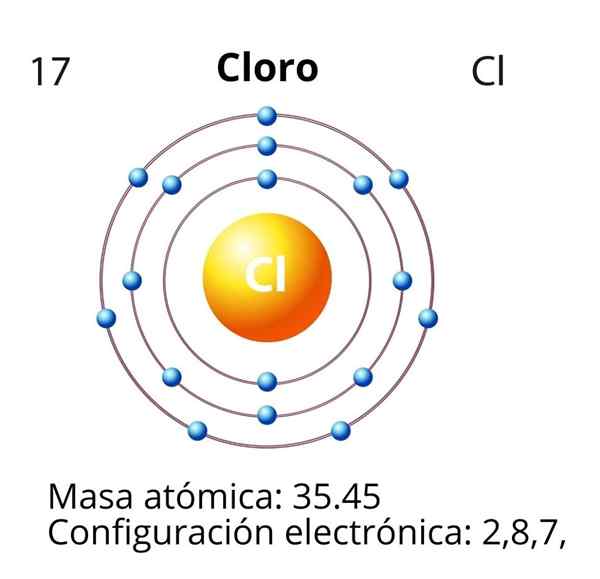
Dalam kasus klorin (cl) angka atomnya z sama dengan 17. Konfigurasi elektronik kemudian 1s22s2sp63S23p5. Orbital ditandai dengan warna merah sesuai dengan lapisan valencia, yang menyajikan level 3 terbuka.
Elektron diferensial adalah elektron terakhir yang ditempatkan dalam konfigurasi elektronik, dan atom klorin adalah dari orbital 3p, yang disposisi adalah sebagai berikut:
↑ ↓ ↑ ↓ ↑ _
3px 3py 3pz
(-1) (0) (+1)
Menghormati aturan wastafel, orbital 3p pertama kali diisi dengan energi yang sama (panah ke atas di setiap orbital). Kedua, elektron lain pasangan dengan elektron kiri ke kanan. Elektron diferensial diwakili dalam bingkai hijau.
Dengan demikian, elektron diferensial untuk klorin memiliki angka kuantum berikut: (3, 1, 0, -1/2). Yaitu, "n" adalah 3; "L" adalah 1, orbital "p"; "M" adalah 0, karena itu adalah "p" orbital dari media; Dan "S" adalah -1/2, karena panah menunjuk ke bawah.
Magnesium
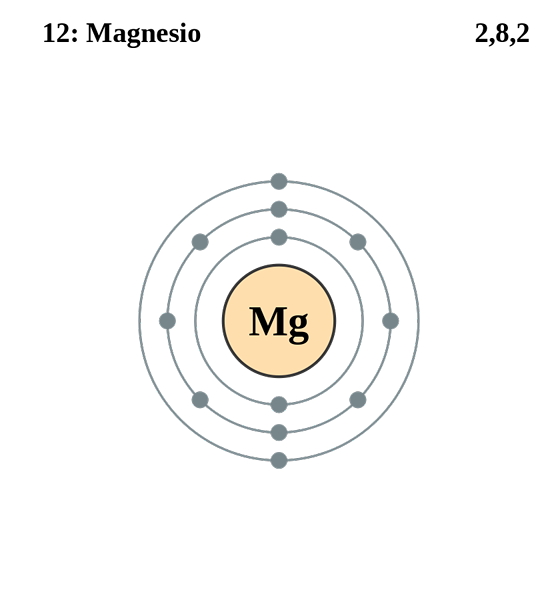 Konfigurasi Magnesium Elektronik. Sumber: electron_shell_012_magnesium.SVG: Pumbaa (karya asli oleh Greg Robson) Karya Derivatif: Kizar, CC BY-SA 3.0, via Wikimedia Commons
Konfigurasi Magnesium Elektronik. Sumber: electron_shell_012_magnesium.SVG: Pumbaa (karya asli oleh Greg Robson) Karya Derivatif: Kizar, CC BY-SA 3.0, via Wikimedia Commons Konfigurasi elektronik untuk atom magnesium adalah 1s22s2sp63S2, Mewakili orbital dan elektron valencia -nya dengan cara yang sama:
↑ ↓
3S
0
Kali ini, elektron diferensial memiliki angka kuantum 3, 0, 0, -1/2. Satu -satunya perbedaan dalam kasus ini sehubungan dengan klorin adalah bahwa angka kuantum "l" adalah 0 karena elektron menempati "s" orbital (3s).
Zirconio
Konfigurasi elektronik untuk atom zirkonium (logam transisi) adalah 1s22s2sp63S23p64s23d104p65S24d2. Dengan cara yang sama seperti kasus sebelumnya, representasi orbital dan elektron Valencia adalah sebagai berikut:
Itu dapat melayani Anda: cyclopentano (c5h10): struktur, sifat dan penggunaan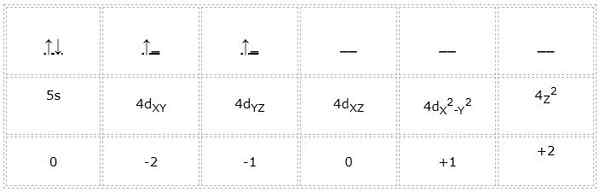
Dengan demikian, angka kuantum untuk elektron diferensial yang ditandai dalam warna hijau adalah: 4, 2, -1, +1/2. Di sini, karena elektron menempati orbital kedua "D", ia memiliki angka kuantum "m" sama dengan -1. Juga, karena panah menunjuk ke atas, nomor putarannya "S" sama dengan +1/2.
Elemen yang tidak diketahui
Jumlah kuantum elektron diferensial untuk elemen yang tidak diketahui adalah 3, 2, +2, -1/2. Berapa angka atom z dari elemen? Mengetahui z dapat menguraikan apa elemennya.
Kali ini, karena "n" adalah 3 yang sama, itu berarti bahwa elemen tersebut berada di periode ketiga dari tabel periodik, dengan orbital "D" sebagai lapisan Valencia ("L" sama dengan 2). Oleh karena itu, orbital direpresentasikan seperti pada contoh sebelumnya:
↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
Angka kuantum "m" sama dengan +2, dan "s" sama dengan -1/2, adalah kunci untuk menemukan elektron diferensial dengan benar dalam orbital 3D terakhir.
Dengan demikian, elemen yang dicari memiliki orbital 3D10 penuh, seperti lapisan elektronik internalnya. Kesimpulannya, elemennya adalah logam seng (Zn).
Namun, jumlah kuantum elektron diferensial tidak dapat membedakan antara seng dan tembaga, karena elemen terakhir ini juga menyajikan orbital 3D penuh. Karena? Karena tembaga adalah logam yang gagal dengan aturan diisi dengan elektron karena alasan kuantum.
Referensi
- Jim Branson. (2013). Aturan wastafel. Diperoleh dari kuantummekanik.UCSD.Edu
- Kuliah 27: Aturan Wastafel. Pulih dari ph.Qmul.Ac.Inggris
- Universitas Purdue. Angka kuantum dan konfigurasi elektron. Diperoleh dari Murmed.Chem.Purdue.Edu
- Salvat Encyclopedia of Science. (1968). Fisika Salvat, s.KE. Edisi Pamplona, Volume 12, Spanyol, hlm. 314-322.
- Walter J. Moore. (1963). Kimia Fisik. Di dalam Partikel dan gelombang. Edisi Keempat, Longmans.

