Karakter logam
- 3260
- 1041
- Herbert Fritsch
Apa karakter logam?
Dia Karakter logam dari elemen Tabel periodik mengacu pada semua variabel, kimia dan fisik tersebut, yang mendefinisikan logam atau membedakannya dari zat alam lain. Mereka biasanya cerah, padat, keras, termal tinggi dan listrik, konduktivitas yang dapat dicetak dan ulet.
Namun, tidak semua logam menunjukkan karakteristik seperti itu; Misalnya, dalam kasus merkuri, ini adalah cairan hitam cerah. Juga, variabel -variabel ini tergantung pada tekanan terestrial dan kondisi suhu. Misalnya, hidrogen non -metalik yang tampaknya dapat berperilaku fisik sebagai logam dalam kondisi ekstrem.
Kondisi ini dapat: di bawah tekanan buruk atau suhu yang sangat dingin di sekitar nol absolut. Untuk mendefinisikan apakah suatu elemen bersifat logam atau tidak, perlu mempertimbangkan pola tersembunyi di mata pengamat: pola atom.
Ini membedakan lebih presisi dan keandalan apa elemen logam, dan bahkan elemen apa yang lebih logam daripada yang lain.
Dengan cara ini, karakter logam sejati dari koin emas lebih banyak berada pada kualitas atomnya daripada yang ditentukan oleh massa emasnya, bahkan keduanya terkait erat.
Manakah dari koin yang lebih logam: salah satu emas, satu tembaga atau platinum? Jawabannya adalah platinum, dan penjelasannya terletak pada atomnya.
Bagaimana memvariasikan karakter logam elemen dalam tabel periodik?
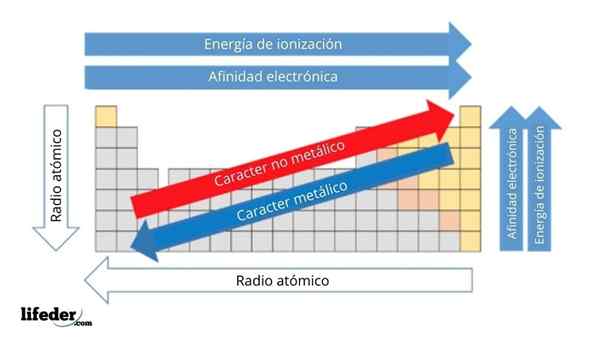
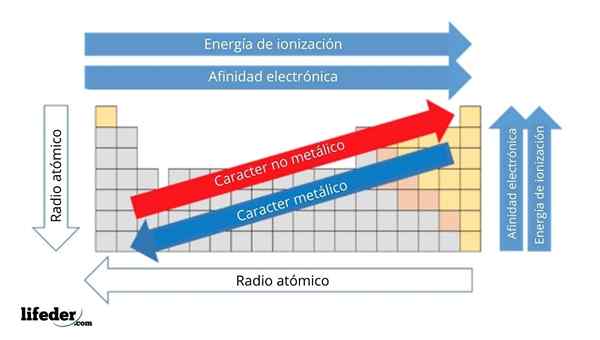
Di gambar atas Anda memiliki sifat periodik elemen. Baris sesuai dengan periode dan kolom ke grup.
Karakter logam berkurang dari kiri ke kanan tabel periodik, dan meningkat ke arah yang berlawanan. Demikian juga, karakter logam meningkat dari atas ke bawah dan berkurang karena periode ditempuh ke kepala kelompok.
Itu dapat melayani Anda: basis: karakteristik dan contohDengan cara ini, elemen -elemen yang dekat dengan arah yang menunjuk panah, memiliki karakter logam yang lebih besar daripada yang terletak di arah yang berlawanan (blok kuning).
Selain itu, panah lain sesuai dengan sifat periodik lainnya, yang menentukan dalam arti apa mereka meningkat atau berkurang karena elemen itu "logam". Misalnya, unsur -unsur blok kuning, meskipun mereka memiliki karakter logam rendah, afinitas elektronik dan energi ionisasi tinggi.
Dalam kasus radio atom, semakin besar, semakin logam elemennya; Ini ditunjukkan oleh panah biru.
Sifat elemen logam
Dalam tabel periodik diamati bahwa logam memiliki radio atom besar, energi ionisasi rendah, afinitas elektronik rendah dan elektronegativitas rendah. Cara menghafal semua properti ini?
Titik yang mengalir adalah reaktivitas (elektropositif) yang mendefinisikan logam, yang teroksidasi; yaitu, mereka kehilangan elektron dengan mudah.
Ketika mereka kehilangan elektron, logam membentuk kation (m+). Oleh karena itu, elemen dengan kation karakter logam tertinggi lebih mudah daripada karakter logam yang lebih rendah.
Contoh dari hal di atas adalah untuk mempertimbangkan reaktivitas unsur -unsur kelompok 2, logam alkalinotherrous. Berilium kurang logam daripada magnesium, dan ini pada gilirannya kurang logam dari kalsium.
Demikianlah sampai mencapai logam bario, yang paling reaktif dari kelompok (setelah jari -jari, elemen radioaktif).
Bagaimana jari -jari atom pada reaktivitas logam mempengaruhi?
Ketika jari -jari atom meningkat, elektron Valencia lebih jauh dari nukleus, sehingga mereka dipertahankan dengan kekuatan yang lebih sedikit dalam atom.
Dapat melayani Anda: natrium hidroksida (NaOH): struktur, sifat, penggunaan, sintesisNamun, jika suatu periode ditempuh ke sisi kanan tabel periodik, nukleus menambahkan proton ke tubuhnya, sekarang lebih positif, yang menarik elektron valensi lebih kuat, mengurangi ukuran jari -jari atom. Ini menghasilkan penurunan karakter logam.
Dengan demikian, atom yang sangat kecil dan dengan nukleus yang sangat positif cenderung mendapatkan elektron alih -alih kehilangannya (elemen non -metalik), dan yang dapat menang dan kehilangan elektron, dianggap sebagai metalloides. Boron, silikon, germanio dan arsenik adalah beberapa metaloid ini.
Di sisi lain, jari -jari atom juga meningkat jika ada ketersediaan energi baru untuk orbital lain, yang terjadi saat turun dalam suatu kelompok.
Untuk alasan ini, ketika turun di tabel periodik, radio menjadi besar dan inti menjadi tidak dapat mencegah spesies lain menyambar elektron dari lapisan luarnya.
Di laboratorium, dengan agen pengoksidasi yang kuat -asam nitrat seperti encer (HNO3)- Reaktivitas logam dalam menghadapi oksidasi dapat dipelajari.
Demikian pula, proses pembentukan halida logam mereka (NaCl, misalnya) juga merupakan percobaan demonstratif dari reaktivitas ini.
Elemen karakter logam yang lebih besar
 Cesium
Cesium Arah panah biru dalam gambar tabel periodik mengarah ke elemen Francio dan Cesio. Francio lebih logam daripada cesium, tetapi tidak seperti yang terakhir, Francio adalah buatan dan radioaktif. Untuk alasan ini, cesium menempati tempat unsur alami dari karakter logam yang lebih besar.
Dapat melayani Anda: besi oksidaFaktanya, salah satu reaksi yang diketahui yang paling terkenal (dan eksplosif) adalah yang terjadi ketika sepotong (atau tetes) cesium bersentuhan dengan air.
Reaktivitas tinggi cesium, juga diterjemahkan ke dalam pembentukan senyawa yang jauh lebih stabil, bertanggung jawab atas pelepasan energi yang tiba -tiba:
2CS (s) + 2H2O → 2csoh (aq) + h2(G)
Persamaan kimia memungkinkan untuk melihat oksidasi cesium dan pengurangan hidrogen air menjadi hidrogen gas.
Elemen karakter logam yang lebih rendah
 Model fluor 3D
Model fluor 3D Di diagonal yang berlawanan, di sudut kanan atas tabel periodik, fluoride (f2, gambar superior) memimpin daftar elemen non -metalik. Karena? Karena itu adalah elemen dalam sifat paling elektronegatif dan yang memiliki energi ionisasi terendah.
Dengan kata lain, ia bereaksi dengan semua elemen tabel periodik untuk membentuk ion f- dan bukan f+.
Fluor sangat tidak mungkin kehilangan elektron dalam beberapa reaksi kimia, cukup bertentangan dengan logam. Karena alasan inilah elemen karakter logam yang lebih rendah.
Referensi
- Lumen, kimia untuk non-jurusan. Karakter logam dan non -metallin. Pulih dari kursus.Lumenarning.com
- Penugasan kimia. (2018). Elektropostivitas atau karakter logam. Pulih dari penugasan kimia.com
- Juan Ramos. Daftar Lengkap Logam dan Non -Logam. Pulih dari sciencetrends.com
- Anne Marie Helmestine, Ph.D. Sifat dan tren karakter logam. Pulih dari Thoughtco.com

