Energi internal
- 2935
- 841
- Leland Robel
Kami menjelaskan apa itu energi internal, fungsinya, bagaimana menghitungnya dan memberikan beberapa contoh
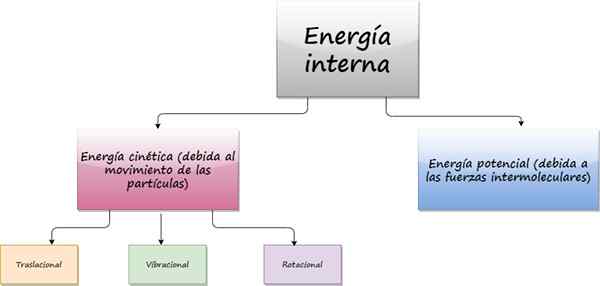
 Diagram menunjukkan kontribusi pada energi internal suatu sistem. Sumber: f. Zapata
Diagram menunjukkan kontribusi pada energi internal suatu sistem. Sumber: f. Zapata Apa itu energi internal?
Itu energi internal Dari suatu objek berasal dari gerakan acak yang dimiliki atom dan molekul. Bahkan ketika objek itu sempurna saat istirahat, di dalam, pada tingkat mikroskopis, partikel -partikel yang menyusunnya bergerak terus menerus tanpa istirahat.
Karena partikel -partikel ini bergerak, mereka memiliki energi kinetik, yang merupakan bagian dari energi internal mereka. Kontribusi lain terhadap energi internal adalah energi potensial yang berasal dari kekuatan antarmolekul, bertanggung jawab untuk mempertahankan kohesi zat tersebut.
Kekuatan antar molekul ini biasanya berasal dari elektromagnetik, tetapi gaya gravitasi dan nuklir juga berpartisipasi.
Sekarang, tergantung pada jenis pergerakan partikel, energi kinetik dapat:
- Translasi
- Getaran
- Rotasi
Suhu hanya mengukur energi kinetik translasi dari partikel. Pada prinsipnya, pada suhu yang lebih besar, energi internal akan lebih besar, tetapi ini juga tergantung pada massa. A contoh Masalah ini mengklarifikasi: gelas dengan air hangat memiliki energi internal lebih sedikit daripada danau pada suhu kamar, meskipun suhu kaca lebih tinggi, dan itu karena ada lebih banyak air di danau daripada di kaca.
Dalam kasus apa pun, energi internal suatu zat tidak terlihat dalam pandangan, itu tidak bergantung pada gerakannya, juga tidak bergantung pada posisi relatifnya sehubungan dengan objek lain. Misalnya, energi internal gelas dengan air pada suhu kamar adalah sama jika kaca ada di atas meja atau jika ada di lantai.
Dapat melayani Anda: vektor non -coplanar: definisi, kondisi, latihanFungsi energi internal
Energi internal, yang biasanya dilambangkan sebagai U, adalah fungsi yang tergantung pada variabel termodinamika sistem, seperti suhu T dan volume V. Oleh karena itu, dapat diekspresikan secara matematis sebagai:
U = u (t, v)
Pada kenyataannya, nilai absolut energi internal suatu sistem tidak relevan, yang penting adalah variasinya, yang dilambangkan dengan huruf Yunani δ ("delta"):
ΔU = u awal - ATAU terakhir
Sekarang, energi internal dapat bervariasi jika panas ditambahkan atau diekstraksi. Menambahkan panas, ada kemungkinan bahwa sistem melakukan pekerjaan tertentu, seperti piston di silinder mesin.
Hukum Termodinamika Pertama
Dari hukum termodinamika pertama itu ditetapkan itu Variasi energi internal Dari sistem yang setara dengan:
ΔU = q - w
Di mana berapa jumlah panas yang ditransfer ke sistem dan w adalah pekerjaan yang dilakukan sistem, jika dilakukan beberapa. Semuanya diukur dalam joule dalam sistem unit internasional.
Jika sistem tidak berfungsi, maka panas yang disediakan digunakan secara keseluruhan untuk meningkatkan energi internal sistem.
Berikut ini berikut dari ekspresi sebelumnya:
- ΔU> 0 berarti bahwa sistem meningkatkan energi internalnya
- ΔU < 0 la energía interna del sistema disminuye
- Q> 0 Sistem menyerap panas
- W> 0 Sistem ini berhasil.
Cara menghitung energi internal?
Gas Ideal Monoatomik
Dalam model gas ideal monoatomik (atom tunggal), partikel tidak berinteraksi satu sama lain, sehingga energi kinetik translasi adalah satu -satunya kontribusi terhadap energi atau gas internal. Ada teorema, disebut Teorema Equiparition, yang menyatakan bahwa setiap tingkat kebebasan memiliki energi yang sama dengan:
Itu dapat melayani Anda: difraksi gelombang: konsep dan contohDi mana t adalah suhu dan r adalah konstanta gas ideal, yang nilainya dalam satuan sistem internasional adalah:
8.314472 j/mol ∙ k
Tingkat Kebebasan mewakili kemungkinan bergerak di seluruh arah tertentu di luar angkasa. Partikel gas yang ideal dapat bergerak dalam tiga arah ruang, oleh karena itu, energi n mol gas adalah:
Jumlah panas
Dengan asumsi bahwa panas ditambahkan ke suatu sistem dan ini tidak berhasil, panas ini hanya digunakan dalam meningkatkan energi internal sistem. Jumlah panas yang harus sebanding dengan massa m sistem dan perubahan suhu:
Q ∝ m⋅Δt
Konstanta proporsionalitas tergantung pada zat dan disebut panas spesifik. Memanggil C ke konstan ini, panasnya adalah:
Q = mc⋅Δt
Karena panas terbalik dalam meningkatkan energi internal:
Q = mc⋅Δt = ΔU
ΔU sesuai dengan variasi Dalam energi internal.
Contoh energi internal
1. Variasi suhu
Perubahan suhu zat pada gilirannya menghasilkan perubahan energi internal mereka. Inilah yang terjadi, misalnya, saat memasak. Dengan memanaskan makanan, agitasi molekulnya meningkat, energi kinetik meningkat dan karenanya melakukan energi internalnya.
2. Energi internal dari dua zat pada suhu yang sama
Dua zat pada suhu yang sama tidak selalu memiliki energi internal yang sama, karena tergantung pada dua kontribusi: energi kinetik dan energi potensial.
Jika zat berada pada suhu yang sama, dapat ditegaskan bahwa energi kinetik translasi dari partikelnya sama, tetapi energi potensial berbeda, karena ini tergantung pada konfigurasi atom konstituen.
Dapat melayani Anda: Tekanan Hidrostatik: Formula, Perhitungan, Contoh, Latihan3. Ekspansi termal
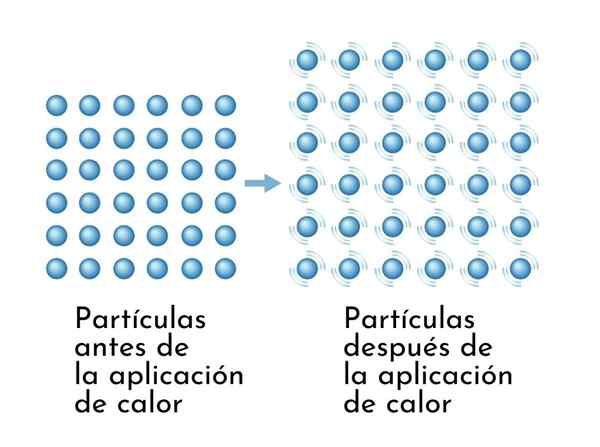 Zat meluas saat dipanaskan, karena peningkatan energi internal menyebabkan partikel mereka bergetar lebih luas, sehingga dimensi meningkat
Zat meluas saat dipanaskan, karena peningkatan energi internal menyebabkan partikel mereka bergetar lebih luas, sehingga dimensi meningkat Konsekuensi yang terlihat dari zat pemanas adalah peningkatan dimensinya, karena jarak rata -rata antara atom -atomnya meningkat.
Kekuatan antar molekul dapat disimulasikan melalui pegas yang menyatukan atom.
4. Gas terkompresi
Gas terkompresi dapat menyimpan energi internal, karena kepadatannya meningkat dengan mengurangi volume dan dengan itu interaksinya dengan dinding wadah wadah. Dengan cara ini gas terkompresi mampu melakukan pekerjaan seperti memindahkan piston.
5. Baterai
Dalam reaksi kimia baterai terjadi yang mampu menghasilkan arus listrik segera setelah sirkuit ditutup. Energi potensial kimia ini dianggap sebagai bagian dari energi internal sistem.
6. Sistem yang menyerap panas dan bekerja
Saat sistem menyerap panas, ia meningkatkan energi internalnya. Tetapi jika pada saat yang sama ia melakukan pekerjaan, hukum termodinamika pertama dapat digunakan untuk mengetahui berapa banyak perubahan energi internal. Misalnya, dengan asumsi bahwa suatu sistem menyerap 175 J panas dan melakukan pekerjaan yang setara dengan 62 J, perubahan energi internalnya adalah:
ΔU = q - w = 175 j - 62 j = 113 j.



