Obligasi kovalen terkoordinasi
- 4365
- 1072
- Tommie Smith
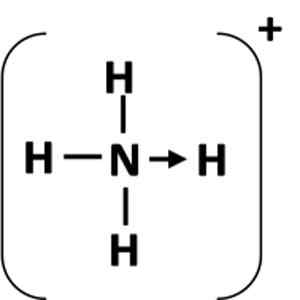
 Gambar 1: Representasi hubungan koordinasi antara atom pemberi (n) dan akseptor (h).
Gambar 1: Representasi hubungan koordinasi antara atom pemberi (n) dan akseptor (h). Apa tautan kovalen terkoordinasi?
A Obligasi kovalen terkoordinasi, atau tautan koordinasi, adalahJenis tautan di mana salah satu atom memasok semua elektron bersama. Itu juga disebut datif atau tautan bipolar.
Dalam tautan kovalen sederhana, setiap atom memasok elektron ke tautan. Di sisi lain, di tautan koordinasi, satu atom menyumbangkan elektron untuk membentuk tautan, dan disebut atom pemberi, sedangkan atom yang menerima sepasang elektron untuk bergabung disebut atom akseptor.
Tautan koordinasi diwakili oleh panah yang dimulai dari atom pemberian dan berakhir dengan atom akseptor (Gambar 1). Dalam beberapa kasus, donor bisa menjadi molekul.
Dalam hal ini, atom dalam molekul dapat menyumbangkan pasangan elektron, yang akan menjadi basis Lewis, sedangkan molekul dengan kapasitas akseptor adalah asam Lewis.
Tautan koordinasi memiliki karakteristik yang mirip dengan ikatan kovalen sederhana. Senyawa yang memiliki jenis tautan ini biasanya memiliki titik peleburan dan didih rendah, dengan interaksi coulombik yang tidak ada antara atom (tidak seperti ikatan ionik) dan senyawa sangat larut dalam air.
Beberapa contoh tautan kovalen terkoordinasi
Contoh paling umum dari tautan koordinasi adalah ion amonium, yang dibentuk oleh kombinasi molekul amonia dan proton dari asam.
Dapat melayani Anda: Persamaan Kimia: Bagian dan ContohDalam amonia, atom nitrogen memiliki sepasang elektron soliter setelah menyelesaikan oktetnya. Selesai pasangan yang sepi ini dengan ion hidrogen, sehingga atom nitrogen menjadi donor. Atom hidrogen menjadi akseptor.
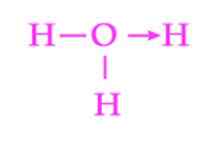 Gambar 2: Representasi Tautan Koordinasi Ion Hidronio
Gambar 2: Representasi Tautan Koordinasi Ion Hidronio Contoh umum lain dari tautan dative adalah pembentukan ion hidronium. Seperti halnya ion amonium, pasangan elektron bebas molekul air berfungsi sebagai pemberi proton yang merupakan akseptor (Gambar 2).
Namun, harus diingat bahwa begitu tautan koordinasi telah ditetapkan, semua hidrogen yang melekat pada oksigen persis setara. Ketika ion hidrogen pecah lagi, tidak ada diskriminasi antara hidrogen yang dilepaskan.
Contoh yang sangat baik dari reaksi asam berbasis asam, yang menggambarkan pembentukan ikatan kovalen yang terkoordinasi adalah reaksi pembentukan aduk boron trifluorida dengan amonia.
Boro trifluoride adalah senyawa yang tidak memiliki struktur gas mulia di sekitar atom boro. Boron hanya memiliki 3 pasang elektron di lapisan valensi, jadi dikatakan bahwa BF3 kekurangan elektron.
Torsi nitrogen nitrogen amonia dapat digunakan untuk mengatasi kekurangan itu, dan senyawa terbentuk yang menyiratkan hubungan koordinasi.
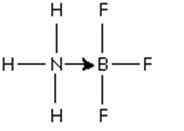 Gambar 3: Adduct antara molekul boron trifluorida dan amonia
Gambar 3: Adduct antara molekul boron trifluorida dan amonia Pasangan elektron nitrogen itu disumbangkan ke orbital p kosong boron. Di sini amonia adalah basis Lewis dan BF3 adalah asam Lewis.
Dapat melayani Anda: valensi nitrogenKimia Koordinasi
Ada cabang kimia anorganik yang didedikasikan secara eksklusif untuk studi senyawa yang membentuk logam transisi. Logam ini berikatan dengan atom atau molekul lain melalui tautan koordinasi untuk membentuk molekul kompleks.
Molekul -molekul ini dikenal sebagai senyawa koordinasi dan sains yang mempelajarinya disebut kimia koordinasi.
Dalam hal ini, zat yang terkait dengan logam, yang akan menjadi pemberi elektron, dikenal sebagai ligasi dan umumnya dengan senyawa koordinasi dikenal sebagai kompleks.
Senyawa koordinasi termasuk zat seperti vitamin B12, hemoglobin dan klorofil, pewarna dan pigmen, dan katalis yang digunakan dalam persiapan zat organik.
Contoh ion kompleks adalah kompleks kobalt [CO (NH2Ch2Ch2NH2) 2clnh3]2+ Itu akan menjadi Dichloroaminethylandiamin Cobalt (IV).
Kimia koordinasi muncul dari karya Alfred Werner, seorang ahli kimia Swiss yang memeriksa berbagai senyawa kobalt klorida (III) dan amoniak. Setelah penambahan asam klorida, Werner mengamati bahwa amonia tidak dapat sepenuhnya dihilangkan. Dia kemudian mengusulkan bahwa amonia harus lebih erat terkait dengan ion kobalt pusat.
Namun, ketika nitrat perak berair ditambahkan, salah satu produk yang terbentuk adalah solid perak chloride. Jumlah perak klorida yang terbentuk terkait dengan jumlah molekul amonia yang terkait dengan kobalt klorida (III).
Misalnya, saat perak nitrat ditambahkan ke cocl3 · 6nh3, Tiga klorida menjadi perak klorida.
Namun, saat perak nitrat ditambahkan ke cocl3 · 5nh3, Hanya 2 dari 3 klorida yang membentuk perak klorida. Saat Cocl3.4nh3 Dengan perak nitrat, salah satu dari tiga klorida diendapkan sebagai perak klorida.
Itu dapat melayani Anda: asam píchrat: apa itu, struktur, sintesis, sifatPengamatan yang dihasilkan menyarankan pembentukan senyawa kompleks atau koordinasi. Dalam bidang koordinasi internal, yang juga disebut dalam beberapa teks sebagai bidang pertama, ligan secara langsung disatukan dengan logam tengah.
Dalam bidang koordinasi eksternal, kadang -kadang disebut bola kedua, ion lain melekat pada ion kompleks. Werner dianugerahi Hadiah Nobel pada tahun 1913 untuk teorinya tentang koordinasinya.
Teori koordinasi ini menyebabkan logam transisi memiliki dua jenis valencia: valencia pertama, ditentukan oleh jumlah oksidasi logam, dan valencia lainnya yang disebut nomor koordinasi.
Jumlah oksidasi mengatakan berapa banyak ikatan kovalen yang dapat dibentuk dalam logam (contoh, zat besi (ii) menghasilkan jelek) dan jumlah koordinasi mengatakan berapa banyak tautan koordinasi yang dapat dibentuk di kompleks (contoh, besi dengan nomor koordinasi 4 menghasilkan [FECL4]- dan [FECL4]2-).
Dalam kasus kobalt, ia memiliki koordinasi nomor 6. Itulah sebabnya dalam percobaan Werner, menambahkan nitrat perak, jumlah perak klorida yang meninggalkan kobalt heksakoordinasi selalu diperoleh.
Tautan koordinasi dari jenis senyawa ini memiliki karakteristik yang diwarnai.
Bahkan, mereka bertanggung jawab atas warna khas yang terkait dengan logam (besi merah, kobalt biru, dll.) dan penting untuk latihan spektrofotometri penyerapan dan emisi atom.
Referensi
- Ikatan Kimia. Pulih dari Britannica.com.
- Mengoordinasikan ikatan kovalen (s.F.). Pulih dari kimia.Tutorvista.

