Karakteristik dan contoh tautan kovalen kutub
- 4222
- 208
- Ray Thiel
A Ikatan kovalen kutub Itu adalah yang terbentuk antara dua elemen kimia yang perbedaan elektronegativitasnya substansial, tetapi tanpa mendekati karakter ionik murni. Dengan demikian ini merupakan interaksi kuat antara antara ikatan kovalen apolar dan tautan ionik.
Dikatakan bahwa itu adalah kovalen karena secara teori ada berbagi yang adil dari pasangan elektronik antara dua atom terkait; yaitu, kedua elektron dibagikan secara merata. Atom E · menyumbangkan elektron, sedangkan · x menyediakan elektron kedua untuk membentuk ikatan kovalen E: x atau e-x.
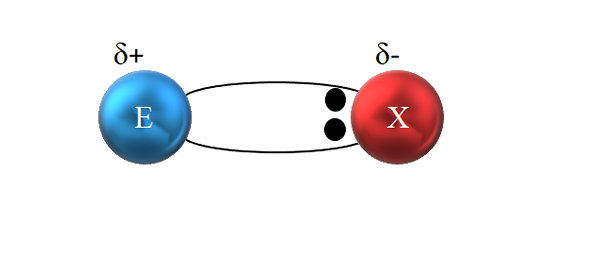
 Dalam ikatan kovalen kutub, pasangan elektron tidak dibagikan secara adil. Sumber: Gabriel Bolívar.
Dalam ikatan kovalen kutub, pasangan elektron tidak dibagikan secara adil. Sumber: Gabriel Bolívar. Namun, seperti yang terlihat pada gambar superior, kedua elektron tidak terletak di tengah E dan X, yang menunjukkan bahwa mereka "bersirkulasi" dengan frekuensi yang sama antara kedua atom; tetapi lebih dekat ke x dari E. Ini berarti bahwa X telah menarik sepasang elektron ke dirinya sendiri karena elektronegativitas yang lebih besar.
Menjadi elektron dari tautan lebih dekat ke x daripada E, sekitar x daerah dengan kepadatan elektronik tinggi dibuat, Δ-; Sementara di E wilayah yang buruk muncul di elektron, Δ+. Oleh karena itu, ada polarisasi muatan listrik: ikatan kovalen kutub.
[TOC]
Karakteristik
Gelar Polaritas
Obligasi kovalen sangat berlimpah. Mereka praktis hadir dalam semua molekul heterogen dan senyawa kimia; Karena, bagaimanapun juga, itu terbentuk ketika dua atom yang berbeda E dan x dihubungkan. Namun, ada lebih banyak ikatan kovalen kutub daripada yang lain, dan untuk mengetahui Anda harus menggunakan elektronegativitas.
Berapa banyak elektronegatif yang adalah x, dan lebih sedikit elektronegatif (elektropositif), maka ikatan kovalen yang dihasilkan akan lebih polar. Mode konvensional untuk memperkirakan polaritas ini adalah melalui rumus:
Dapat melayani Anda: natrium borohidrida (nabh4): struktur, sifat, penggunaanχX - χDAN
Di mana χ adalah elektronegativitas dari masing -masing atom sesuai dengan skala Pauling.
Jika pengurangan atau pengurangan ini memiliki nilai antara 0,5 dan 2, maka itu akan menjadi tautan kutub. Oleh karena itu, dimungkinkan untuk membandingkan tingkat polaritas antara beberapa tautan E-X. Jika nilai yang diperoleh lebih tinggi dari 2, ada pembicaraan tentang tautan ionik, dan+X- Dan tidakδ+-Xδ-.
Namun, polaritas tautan E-X tidak absolut, tetapi tergantung pada lingkungan molekuler; Yaitu, dalam molekul -e-x-, di mana e dan x membentuk ikatan kovalen dengan atom lain, yang terakhir secara langsung mempengaruhi tingkat polaritas itu.
Elemen kimia yang berasal dari mereka
Sedangkan E dan X dapat berupa elemen apa pun, tidak semuanya berasal dari ikatan kovalen kutub. Misalnya, jika E adalah logam yang sangat elektropositif, seperti alkali (Li, Na, K, RB dan CS), dan x halogen (F, CL, BR dan I), mereka akan cenderung membentuk senyawa ionik (NA+Cl-) dan bukan molekul (na-cl).
Itulah sebabnya ikatan kovalen kutub biasanya antara dua elemen non -metalik; dan pada tingkat yang lebih rendah, antara elemen non -metalik dan beberapa logam transisi. Melihat blok P Dari tabel periodik, ada banyak pilihan untuk membentuk jenis tautan kimia ini.
Karakter kutub dan ionik
Dalam molekul besar tidak penting untuk memikirkan bagaimana tautan kutub; Ini sangat kovalen, dan distribusi muatan listrik mereka (di mana daerah elektron yang kaya atau buruk) lebih perhatian untuk menentukan tingkat kovalensi hubungan internal mereka.
Dapat melayani Anda: kromatografi gasNamun, dengan molekul diatomik atau kecil, kata polaritas danδ+-Xδ- Itu cukup relatif.
Ini bukan masalah dengan molekul yang terbentuk antara elemen non -metalik; Tetapi ketika transisi atau logam metaloid berpartisipasi, tidak ada lagi pembicaraan tentang ikatan kovalen kutub, tetapi dari ikatan kovalen dengan karakter ionik tertentu; dan dalam kasus transisi logam, dari tautan koordinasi kovalen mengingat sifat yang sama.
Contoh ikatan kovalen kutub
BERSAMA
Ikatan kovalen antara karbon dan oksigen adalah polar, karena yang pertama lebih sedikit elektronegatif (χC = 2.55) bahwa yang kedua (χSALAH SATU = 3.44). Oleh karena itu, ketika kita melihat tautan c-o, c = o o c-o-, Kita akan tahu bahwa mereka adalah tautan kutub.
H-X
Hidrogen halogenida, HX, adalah contoh ideal untuk memahami ikatan kutub dalam molekul diatomiknya. Memiliki elektronegativitas hidrogen (χH = 2.2), kita dapat memperkirakan seberapa polar halogenuros ini:
-Hf (h-f), χF (3.98) - χH (2,2) = 1.78
-HCl (H-Cl), χCl (3,16) - χH (2,2) = 0,96
-HBR (H-BR), χBr (2.96) - χH (2,2) = 0,76
-Hai (h-i), χyo (2.66) - χH (2,2) = 0,46
Perhatikan bahwa menurut perhitungan ini, tautan H-F adalah yang paling kutub dari semuanya. Sekarang, apa karakter ioniknya yang dinyatakan sebagai persentase, adalah topik lain. Hasil ini tidak mengherankan karena fluor adalah elemen paling elektronegatif dari semuanya.
Saat elektronegativitas turun dari klorin ke yodium, tautan H-Cl, H-BR dan H-I menjadi kurang polar. Tautan H-I harus apolar, tetapi pada kenyataannya itu polar dan juga sangat "rapuh"; rusak dengan mudah.
Dapat melayani Anda: Merkurius Hydroxide: Struktur, Properti, Penggunaan, RisikoOH
Tautan Polar O-H mungkin yang paling penting: terima kasih kepadanya ada kehidupan, karena ia berkolaborasi dengan momen dipol air. Jika kami memperkirakan perbedaan antara elektronegatifitas oksigen dan hidrogen yang akan kami miliki:
χSALAH SATU (3.44) - χH (2,2) = 1.24
Namun, molekul air, h2Atau, ia memiliki dua tautan ini, h-o-h. Ini, dan geometri sudut molekul dan asimetri, menjadikannya senyawa yang sangat polar.
N-H
Tautan N-H hadir dalam kelompok amino protein. Mengulangi perhitungan yang sama yang kami miliki:
χN (3.04) - χH (2,2) = 0,84
Ini mencerminkan bahwa tautan N-H kurang polar daripada O-H (1,24) dan F-H (1,78).
Jelek
Tautan Fe-O penting karena oksida mereka ditemukan dalam mineral besi. Mari kita lihat apakah itu lebih kutub dari H-O:
χSALAH SATU (3.44) - χKeyakinan (1.83) = 1.61
Dari sini seharusnya, bahwa tautan Fe-O lebih polar daripada tautan H-O (1,24); atau apa yang sama dengan mengatakan: Fe-o memiliki karakter ion yang lebih besar daripada H-O.
Perhitungan ini berfungsi untuk muncul tingkat polaritas antara beberapa tautan; Tetapi mereka tidak cukup untuk memutuskan apakah suatu senyawa adalah ionik, kovalen, atau karakter ioniknya.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Laura Nappi. (2019). Ikatan kovalen polar dan nonpolar: definisi dan contoh. Belajar. Pulih dari: belajar.com
- Helmestine, Anne Marie, PH.D. (18 September 2019). Definisi dan contoh ikatan kutub (ikatan kovalen kutub). Pulih dari: thinkco.com
- Elsevier b.V.(2019). Ikatan kovalen kutub. Ilmiah. Diperoleh dari: Scientedirect.com
- Wikipedia. (2019). Polaritas Kimia. Diperoleh dari: di.Wikipedia.org
- Anonim. (5 Juni 2019). Sifat ikatan kovalen kutub. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- « Origine, karakteristik, bagian, fungsi, jenis, jenis
- 80 alasan mengapa aku mencintaimu atau cinta »

