Entalpi reaksi, termokimia, latihan

- 1166
- 32
- Dewey Runolfsdottir
Itu entalpi reaksi Ini adalah fungsi termodinamika yang memungkinkan Anda menghitung panas yang diperoleh atau dikirim ke reaksi kimia, asalkan reaksi ini telah terjadi pada tekanan konstan. Ini didefinisikan sebagai energi internal atau ditambah produk tekanan p oleh volume v zat yang terlibat dalam reaksi kimia, sebagai berikut: h = u + p ∙ v
Oleh karena itu entalpi memiliki dimensi energi, dan dalam sistem langkah -langkah internasional diukur dalam joule. Untuk memahami hubungan entalpi dengan panas yang dipertukarkan dalam reaksi kimia, perlu untuk mengingat hukum pertama termodinamika, yang menetapkan yang berikut: q = ΔU + w
 Gambar 1. Dalam pembakaran gas, entalpi berkurang. Sumber: Pixabay
Gambar 1. Dalam pembakaran gas, entalpi berkurang. Sumber: Pixabay Undang -undang pertama menetapkan bahwa panas yang dipertukarkan dalam proses termodinamika sama dengan variasi energi internal zat yang terlibat dalam proses ditambah pekerjaan yang dilakukan oleh zat -zat ini dalam proses.
Dalam proses apa pun, pekerjaan dihitung oleh hubungan berikut:

Dalam ekspresi sebelumnya VI adalah volume awal, VF volume akhir dan p tekanan. Jika proses dilakukan di bawah tekanan konstan P, maka pekerjaan yang dihasilkan adalah:
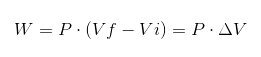
Dimana ΔV adalah variasi volume.
[TOC]
Definisi
Reaksi kimia adalah proses termodinamika yang umumnya terjadi di bawah tekanan konstan dan sangat sering pada tekanan atmosfer. Jenis proses termodinamika ini disebut "isobarik", karena terjadi pada tekanan konstan.
Dalam hal ini hukum termodinamika pertama dapat ditulis seperti ini:
QP = ΔU + p ∙ ΔV
Di mana QP menunjukkan bahwa panas telah dipertukarkan pada tekanan konstan. Jika definisi entalpi h = u + p ∙ v diperoleh maka:
QP = ΔH
Dari sana Anda harus mengubah entalpi positif menunjukkan reaksi yang telah mengambil panas dari lingkungan. Ini adalah reaksi endotermik.
Dapat melayani Anda: ton: transformasi, kesetaraan dan latihan diselesaikanSebaliknya, jika perubahan entalpi negatif maka reaksi eksotermik.
Faktanya, kata entalpi berasal dari kata Yunani Entalpien, yang artinya "panas".
Seringkali entalpi juga disebut panas. Tetapi harus jelas bahwa itu tidak sama dengan panas, tetapi itu adalah pertukaran panas selama proses termodinamika yang mengubah entalpi.
Hubungan panas
Tidak seperti panas, entalpi adalah fungsi negara bagian. Ketika perubahan entalpi dihitung, perbedaan dua fungsi yang bergantung secara eksklusif pada status sistem seperti energi dan volume internal sedang dihitung.
ΔH = ΔU + P ∙ ΔV
Seperti dalam reaksi, tekanan tetap konstan, sehingga entalpi reaksi adalah fungsi keadaan yang hanya tergantung pada energi dan volume internal.
Dalam reaksi kimia, entalpi reagen dapat didefinisikan sebagai jumlah dari masing -masing; dan produk sebagai jumlah entalpi semua produk.
Perubahan entalpi dalam suatu reaksi adalah perbedaan produk kecuali reagen:

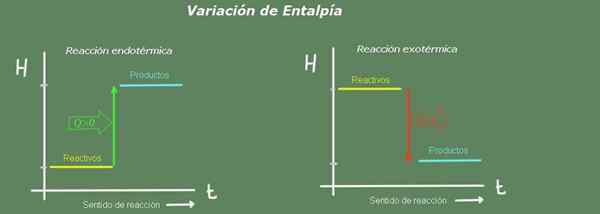 Gambar 2. Diagram Enthalpy. Sumber: Made sendiri.
Gambar 2. Diagram Enthalpy. Sumber: Made sendiri. Dalam reaksi endotermik entalpi produk lebih besar dari reagen; yaitu, reaksi membutuhkan panas dari lingkungan. Sebaliknya, dalam reaksi eksotermik entalpi reagen lebih besar dari produk, karena reaksi memberikan panas pada lingkungan.
Entalpi standar
Karena perubahan entalpi dalam reaksi kimia dapat bergantung pada tekanan dan suhu, adalah biasa untuk menentukan kondisi reaksi standar:
Itu dapat melayani Anda: Kurva Kalibrasi: Untuk apa itu, bagaimana melakukannya, contohSuhu Reaksi Standar: 25 ° C.
Tekanan reaksi standar: 1 atm = 1 batang.
Entalpi standar dilambangkan sebagai berikut: H °
Kimia panas
Dalam persamaan termokimia tidak hanya materi reagen dan produk, variasi entalpi juga penting. Enthalpy dipahami sebagai reaksi terhadap perubahan dirinya yang memiliki tempat selama hal yang sama.
Sebagai contoh, mari kita lihat reaksi berikut:
2 H2 (Gas) + O2 (Gas) → 2 H2O (cairan); ΔH ° = -571,6 kJ (eksotermik).
H2 (gas) + (½) O2 (gas) → H2O (cairan); ΔH ° = -285,8 kJ (eksotermik).
2 H2O (cairan) → 2 H2 (Gas) + O2 (Gas); ΔH ° = +571,6 kJ (endotermik).
Enthalpy adalah jumlah termodinamika yang luas
Jika ketentuan persamaan kimia dikalikan atau dibagi dengan faktor tertentu, maka entalpi dikalikan atau dibagi dengan itu.
Jika reaksi diinvestasikan, maka tanda entalpi reaksi juga diinvestasikan.
Latihan terpecahkan
-Latihan 1
Gas asetilena C2H2 diperoleh dari reaksi kalsium karbida CaC2 yang datang dengan cara granulasi dengan air di lingkungan dan tekanan lingkungan.
Sebagai data, ada entalpi pembentukan reagen:
ΔH ° (CAC2) = -59,0 kJ/mol
ΔH ° (H20) = -285,8 kJ/mol
Dan entalpi pembentukan produk:
ΔH ° (C2H2) = +227.0 kJ/mol
ΔH ° (CA (OH) 2) = -986.0 kJ/mol
Temukan entropi standar reaksi.
Larutan
Hal pertama adalah meningkatkan persamaan kimia yang seimbang:
CAC2 (S) + 2H20 (L) → CA (OH) 2 (S) + C2H2 (g)
Dan sekarang entalpen reagen, produk, dan reaksi:
- Reagen: -59.0 kJ/mol -2 ∙ 285.8 kJ/mol = -630.6 kJ/mol
- Produk: -986.0 kJ/mol + 227.0 kJ/mol = -759 kJ/mol
Itu bisa melayani Anda: apa itu vektor coplanares? (Dengan latihan terpecahkan)- Reaksi: ΔH ° = -759 kJ/mol -( -630 kJ/mol) = -129 kJ/mol
Itu adalah reaksi eksotermik.
-Latihan 2
Saat 1 liter asetilena terbakar dalam kondisi standar, berapa banyak panas yang dilepas?
Larutan
Reaksi pembakaran asetilena sekali seimbang seperti ini:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (l)
Kami membutuhkan entalpi pelatihan produk:
ΔH ° (CO2) = -393,5 kJ/mol
ΔH ° (H2O (L)) = -285,8 kJ/mol
Perhitungan entalpi
Dengan data ini kita dapat menghitung entalpi produk:
ΔH ° (produk) = 2*(-393,5 kj/mol) + (-285,8 kj/mol) = -1072,8 kJ/mol
Dan entalpi formasi reagen:
ΔH ° (C2H2) = 227,0 kJ/mol
ΔH ° (O2) = 0,0 kJ/mol
Entalpi reagen adalah:
227.0 kJ/mol + (5/2)* 0.0 = 227.0 kJ/mol
Entalpi reaksi molar kemudian akan menjadi: ΔH ° (produk) - ΔH ° (reagen) = -1072.8kj/mol - 227.0 kJ/mol = -1299.8 kJ/mol
Entalpi pembakaran
Sekarang kita perlu tahu berapa mol asetilena yang merupakan liter asetilena dalam kondisi standar. Untuk ini kami akan menggunakan persamaan keadaan gas ideal, dari mana kami akan menghapus jumlah mol.
Jumlah mol n = p*v/(r*t)
P = 1 atm = 1.013 x 10⁵ pa
V = 1 l = 1.0 x 10^-3 m³
R = 8.31 j/(mol*k)
T = 25 ° C = 298.15 K
N = 0,041 mol
Entalpi pembakaran 1 liter asetilena adalah 0,041 mol * (-129,8 kJ/mol) = -53,13 kJ
Tanda negatif menunjukkan bahwa itu adalah reaksi eksotermik yang mengeluarkan 53,13 kJ = 12,69 kkal.
Referensi
- Castaños e. Entalpi dalam reaksi kimia. Pulih dari: lidiaconlachimica.WordPress.com
- Kimia panas. Entalpi reaksi. Diperoleh dari: sumber daya.pendidikan.adalah
- Kimia panas. Definisi entalpi reaksi standar. Dipulihkan dari: Quimitube.com
- Wikipedia. Entalpi reaksi standar. Pulih dari: wikipedia.com
- Wikipedia. Melatih entalpi. Pulih dari: wikipedia.com
- « Rumus kesalahan relatif, bagaimana itu dihitung, latihan
- Apa upaya penugasan dan bagaimana mendapatkannya? »

