Karakteristik enzim karakteristik, mekanisme aksi, contoh
- 1916
- 440
- Irvin Reichel
A Enzim alosterik (Dari bahasa Yunani: allo, berbeda + stereos, ruang tiga dimensi) adalah protein di mana interaksi tidak langsung diproduksi antara situs yang berbeda secara topografi, oleh penyatuan substrat dan molekul regulasi (ligan).
Persatuan ligan ke situs tertentu dipengaruhi oleh penyatuan ligan efektor lain (atau memodulasi ligan) ke situs lain (alosterik) dari enzim lainnya. Ini dikenal sebagai interaksi alestherical, atau interaksi kooperatif.
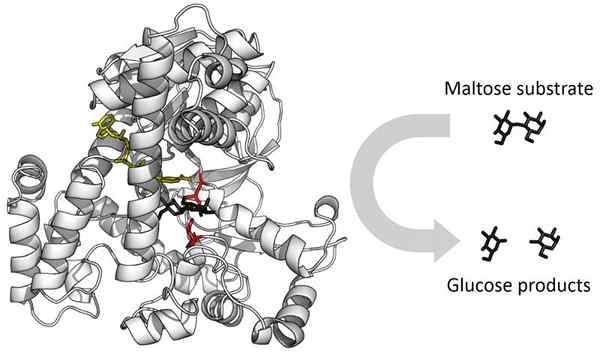
 Contoh enzim. Sumber: Thomas Shafee [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Contoh enzim. Sumber: Thomas Shafee [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Ketika ligan efektor meningkatkan afinitas penyatuan ligan lain ke enzim, kooperatif adalah positif. Saat afinitas mengurangi kooperatif adalah negatif. Jika dua ligan yang sama berpartisipasi dalam interaksi kooperatif, efeknya homotropik, dan jika kedua ligan berbeda, efeknya heterotropik.
Interaksi kooperatif menghasilkan perubahan reversibel dalam struktur molekul enzim, pada tingkat struktur tersier dan kuaterner. Perubahan ini dikenal sebagai perubahan konformasi.
[TOC]
Sejarah
Konsep interaksi alestrik muncul lebih dari 50 tahun yang lalu. Itu telah berkembang dari waktu ke waktu, yaitu:
-Pada tahun 1903, kurva sigmoidal oksigen hemoglobin diamati.
-Pada tahun 1910, kurva sigmoidal persatuan O O2 Hemoglobin secara matematis dijelaskan oleh persamaan Hill.
-Pada tahun 1954, Novick dan Szilard menunjukkan bahwa enzim yang terletak di awal jalur metabolisme dihambat oleh produk akhir dari rute ini, yang dikenal sebagai umpan balik negatif.
-Pada tahun 1956, Umbarger menemukan bahwa patah hati L-treonine, enzim pertama dari biosintesis L-isoleusin, dihambat oleh L-isoleusin, dan bahwa itu tidak menunjukkan kinetika khas Michaelis -mente dengan kurva hiperbolik, tetapi itu telah terjadi, tetapi itu telah memiliki kurva hiperbolik, tetapi itu telah memiliki kurva hiperbolik, tetapi itu telah memiliki kurva hiperbolik, tetapi itu telah memiliki kurva hiperbolik dengan hiperbolik dengan kurva hiperbolik, tetapi itu telah memiliki kurva hiperbolik, tetapi itu telah memiliki kurva hiperbolik, tetapi itu telah memiliki kurva hiperbolik dengan kurva hiperbolik dengan kurva hiperbolik dengan kurva hiperbolik, tetapi itu kurva sigmoidal.
-Pada tahun 1963, Perutz et al., Mereka ditemukan oleh X -rays perubahan konformasi pada struktur hemoglobin saat mengikat oksigen. Monod dan Jacob berganti nama menjadi situs peraturan sebagai "situs alestheric".
-Pada tahun 1965, Monod, Wyman dan Changeux mengusulkan model simetris, atau model MWC (huruf awal monod, wyman dan changeux) untuk menjelaskan interaksi alestheric.
-Pada tahun 1966, Koshland, Nemethy dan Filmer mengusulkan model kopling berurutan atau diinduksi, atau model KNF, untuk menjelaskan interaksi alestheric.
-Pada tahun 1988, struktur x -ray dari transcarbamilasa aspartate menunjukkan model simetris yang dipostulatkan oleh Monod, Wyman dan Changexux.
-Pada 1990 -an, mutasi, modifikasi kovalen dan perubahan pH dianggap sebagai efektor alosterik.
-Pada tahun 1996, struktur x -ray Lac menunjukkan transisi ke poster.
Mekanisme dan contoh aksi
-Karakteristik model MWC dan KNF dari regulasi alosterik
Model MWC
Hipotesis model MWC asli mengusulkan yang berikut (Monod, Wyman, Changeux, 1965)
Dapat melayani Anda: flora dan fauna entre ríos: spesies representatifProtein alosterik adalah oligomer yang dibentuk oleh protomer terkait simetris. Protomer terdiri dari subunit atau rantai polipeptida.
Oligomer memiliki setidaknya dua keadaan konformasi (R dan T). Kedua negara bagian (dari struktur kuaterner) secara spontan menetapkan keseimbangan, dengan atau tanpa menghubungkan bersama.
Ketika transisi dari satu keadaan ke keadaan lain terjadi, simetri dipertahankan, dan afinitas situs (atau beberapa) situs yang ditentukan terhadap ligan diubah.
Dengan cara ini, Ligandos Cooperative Union berlanjut dari interaksi koperasi antara subunit.
Model KNF
Hipotesis model KNF mengusulkan yang berikut (Koshland, Nemethy, Filmer, 1966): The Binding Union menghasilkan perubahan dalam struktur tersier dalam subunit. Perubahan konformasi ini mempengaruhi subunit tetangga.
Afinitas pengikat ligan protein tergantung pada jumlah ligan yang tetap bersama. Oleh karena itu, proteinosterik memiliki banyak keadaan konformasi yang mencakup keadaan menengah.
Selama lima dekade terakhir, model MWC dan KNF telah dievaluasi dengan studi biokimia dan struktural. Itu ditunjukkan bahwa banyak protein alestheric, termasuk enzim, mematuhi apa yang diusulkan dalam model MWC, meskipun ada pengecualian.
Model MWC dan enzim alestherical (atau enzim pengatur)
Enzim alosterik sering lebih besar dan lebih kompleks daripada enzim non -alesterik. Transcarbamilase aspartate (aspcarbamilasa atau atcasa) dan fosfofructica-1 (PFK-1) adalah contoh klasik enzim alestheric yang memenuhi model MWC.
Atcasa dari DAN. coli
ATCASA mengkatalisasi reaksi pertama dari biosintesis nukleotida pirimidin (CTP dan UTP) dan menggunakan ASP sebagai substrat. Struktur atcasa terdiri dari subunit katalitik dan peraturan. Atcasa memiliki dua negara konformasi r dan t. Simetri antara kedua keadaan ini dilestarikan.
Kinetika atcasa (kecepatan awal atcas. Ini menunjukkan bahwa ATCASA memiliki perilaku kooperatif.
ATCASA dihambat oleh umpan balik CTP. Kurva sigmoid atcasa, di hadapan CTP, adalah di sebelah kanan kurva sigmoid ATCA. Peningkatan nilai konstan michaelis-mindly (KM).
Yaitu, di hadapan CTP, ATCAVMax), Dibandingkan dengan atcasa tanpa adanya CTP.
Itu dapat melayani Anda: granulopoyesis: karakteristik, hematologi, fase dan faktorSebagai kesimpulan, CTP adalah efektor negatif heterotropik karena afinitas atcasa dengan aspartat berkurang. Perilaku ini dikenal sebagai kooperativitas negatif.
PFK-1
PFK-1 mengkatalisasi reaksi ketiga dari jalur glikolisis. Reaksi ini terdiri dari transfer gugus fosfat dari ATP ke fruktosa 6-fosfat. Struktur PFK-1 adalah tetrameter, yang menunjukkan dua keadaan konformasi R dan T. Simetri antara kedua keadaan ini dilestarikan.
Kinetika PFK-1 (kecepatan awal dengan konsentrasi fuktosa 6-fosfat yang berbeda) menunjukkan kurva sigmoid. PFK-1stá tunduk pada regulasi alostrik yang kompleks oleh ATP, AMP dan Frutosa-2,6-bifosfat, yaitu:
Kurva sigmoid dari PFK-1, dengan adanya konsentrasi ATP yang tinggi, adalah di sebelah kanan kurva sigmoid pada konsentrasi ATP rendah (Gambar 4). Peningkatan nilai konstan michaelis-mindly (KM).
Dengan adanya konsentrasi ATP yang tinggi, PFK-1 membutuhkan konsentrasi fruktosa 6-fosfat yang lebih besar untuk mencapai setengah dari kecepatan maksimum (VMax).
Sebagai kesimpulan, ATP, selain menjadi substrat, adalah alostroéric heterotropik negatif.
Kurva sigmoid dari PFK-1, di hadapan AMP, terletak di sebelah kiri kurva sigmoid dari PFK-1 di hadapan ATP. Yaitu, amp menghilangkan efek inhibitor ATP.
Di hadapan AMP, PFK-1 membutuhkan konsentrasi fruktosa 6-fosfat yang lebih rendah untuk mencapai setengah dari kecepatan maksimum (VMax). Ini dimanifestasikan dalam kenyataan bahwa ada penurunan nilai konstanta Michaelis -men Michaelis (KM).
Sebagai kesimpulan, AMP adalah alostroar heterotropik positif karena afinitas serikat PFK-1 meningkat dengan fruktosa 6-fosfat. Frutosa-2,6-biphosphate (f2.6bp) adalah aktivator alostrik yang kuat dari PFK-1 (Gambar 5), dan perilakunya mirip dengan AMP.
Model MWC adalah umum, tetapi tidak universal
Dari total struktur protein yang disimpan dalam PDB (bank data protein), setengahnya adalah oligomer dan setengah lainnya adalah monomer. Telah ditunjukkan bahwa kooperativitas tidak memerlukan banyak ligan, atau beberapa subunit perakitan. Ini adalah kasus glycoquinase dan enzim lainnya.
Glucoquinase adalah monomer, memiliki rantai polipeptida, dan menunjukkan kinetik sigmoidal sebagai respons terhadap peningkatan konsentrasi glukosa darah (Porter dan Miller, 2012; Kamata et al., 2004).
Dapat melayani Anda: parasitisme: konsep, jenis dan contohAda model yang berbeda yang menjelaskan kinetika kooperatif dalam enzim monomer, yaitu: model mnemonik, model transisi yang diinduksi lambat yang diinduksi lambat, penambahan substrat secara acak dalam reaksi biomolekul, jenis perubahan konformasi yang lambat, antara lain, antara lain perubahan konformasi, antara lain, antara konformasi, antara lain, antara konformasi, antara konformasi, antara konformasi, antara lain, antara konformasi, antara konformasi, antara lain, antara.
Studi Struktur Glycoquinase telah mendukung model mnemonik
Glikokinase manusia normal memiliki a KM 8 mm untuk glukosa. Nilai ini dekat dengan konsentrasi glukosa darah.
Ada pasien yang menderita hiperinsulinemia pessista masa kanak -kanak (akronim dalam bahasa Inggris, PHHI). Glikokinase pasien ini memiliki a KM Untuk glukosa dengan nilai lebih rendah dari glikokinas normal, dan koperasi penting.
Akibatnya, pasien ini memiliki varian glikokinase yang hiperaktif, yang dalam kasus parah bisa mematikan.
Aplikasi alosterisme
Alostería dan katalisis terkait erat. Karena itu, efek alestheric dapat mempengaruhi karakteristik katalisis seperti pengikatan ligan, pelepasan ligan.
Situs serikat alosterik dapat menjadi target obat -obatan baru. Ini karena fakta bahwa efektor alkal dapat mempengaruhi fungsi enzim. Identifikasi situs alosterik adalah langkah pertama untuk penemuan obat yang meningkatkan fungsi enzim.
Referensi
- Changeux, J.P. 2012. Model alostery dan monod-wyman-changeux setelah 50 tahun. Tinjauan Tahunan Biofisika dan Struktur Biomolekul, 41: 103-133.
- Changeux, J.P. 2013. 50 tahun interaksi alosterik: tikungan dan belokan model. Biologi Sel Molekul, di Nature Reviews, 14: 1-11.
- Goodey, n.M. dan Benkovic, s.J. 2008. Regulasi dan katalisis alosterik muncul melalui rute umum. Nature Chemical Biology, 4: 274-482.
- Kamata, k., Mitsuya, m., Nishimura, t., Eiki, Jun-Hichi, Nagata, dan. 2004. Dasar Struktural Untuk Pengaturan Alosterik Enzim Allosterik Monomer Glucokinase Manusia. Struktur, 12: 429-438.
- Koshland, d.DAN. Jr., Nemethy, g., Filmer, d. 1966. Perbandingan data pengikatan eksperimental dan model teoritis dalam protein contouns. Biokimia, 5: 365-385.
- Monod, J., Wyman, J., Changeux, J.P. 1965. Tentang sifat transisi alosterik: ke model yang masuk akal. Jurnal Biologi Molekuler, 12: 88-118.
- Nelson, d.L. dan Cox, m.M., 2008. Lehninger-prinsip biokimia. W.H. Freeman and Company, New York.
- Porter, c.M. dan Miller, b.G. 2012. Kooperatifitas dalam enzim monomer dengan situs pengikat ligan tunggal. Kimia Bioorganik, 43: 44-50.
- Voet, d. dan voet, j. 2004. Biokimia. John Wiley and Sons, AS.
- « Fungsi BETTIVE APA YANG ADA, Bagaimana cara melakukannya, contoh, latihan
- Teori evolusi biologis, proses, tes dan contoh »

