Penjelasan Keseimbangan Kimia, Faktor, Jenis, Contoh

- 1604
- 122
- Dewey Runolfsdottir
Dia keseimbangan kimia Ini adalah keadaan yang mencapai reaksi kimia reversibel di mana tidak ada variasi konsentrasi, atau reagen, atau produk yang terlibat diproduksi. Ini ditandai dengan menjadi dinamis dan tidak statis; yaitu, molekul atau atom terus bereaksi, tetapi mempertahankan konsentrasi yang sama selama waktu.
Saldo yang serupa juga disajikan dalam perubahan fase, meskipun tidak ada jeda tautan. Misalnya, cairan bisa seimbang dengan uapnya, serta sebagai padatan. Demikian juga, padatan menetapkan keseimbangan dengan air yang mengelilinginya ketika telah diendapkan atau dikristalisasi.
 Dalam industri kimia, pengetahuan tentang keseimbangan kimia sangat penting untuk mendapatkan sintesis dengan hasil yang lebih baik. Sumber: Pxhere.
Dalam industri kimia, pengetahuan tentang keseimbangan kimia sangat penting untuk mendapatkan sintesis dengan hasil yang lebih baik. Sumber: Pxhere. Setelah keseimbangan kimianya ditetapkan, tidak mungkin untuk mendapatkan lebih banyak perubahan atau respons kecuali jika terganggu atau dipengaruhi oleh tindakan eksternal. Dengan demikian, dalam sintesis suatu produk, beberapa parameter seperti tekanan, volume atau suhu dimodifikasi, sehingga jumlah maksimum produk dihasilkan dalam keseimbangan.
Kalau tidak, dalam keseimbangan jumlah produk tidak memuaskan; yaitu, akan ada kinerja reaksi yang buruk. Itulah sebabnya keseimbangan kimianya sangat penting untuk industri kimia, dan secara umum untuk sintesis apa pun terlepas dari skalanya.
Dalam keseimbangan kimia mungkin ada lebih banyak produk, atau lebih banyak reagen. Itu semua tergantung di mana keseimbangan dipindahkan. Mempertimbangkan beberapa faktor, Anda dapat memindahkan keseimbangan ke salah satu dari dua arah panah ganda dalam reaksi reversibel.
[TOC]
Penjelasan keseimbangan kimia
Sebelum keseimbangan
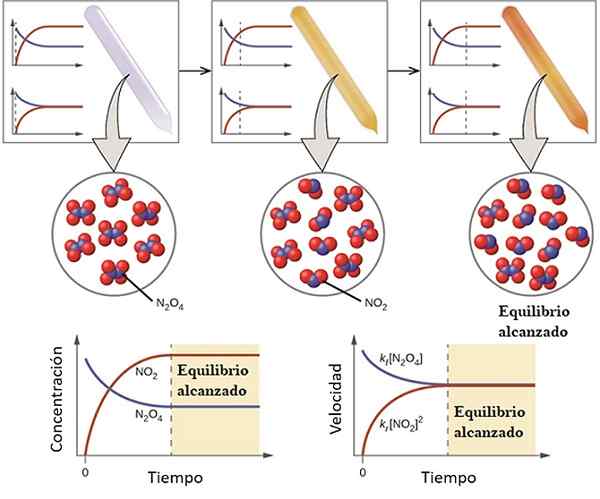 Contoh bagaimana reaksi mendekati keseimbangannya. Sumber: OpenStax/CC oleh (https: // createveCommons.Org/lisensi/oleh/4.0)
Contoh bagaimana reaksi mendekati keseimbangannya. Sumber: OpenStax/CC oleh (https: // createveCommons.Org/lisensi/oleh/4.0) Untuk memahami apa keseimbangan kimianya yang dipertimbangkan, reaksi reversibel berikut:
N2SALAH SATU4(g) ⇌ Tidak2(G)
Gas n2SALAH SATU4 Itu tidak berwarna, sedangkan gas tidak2 menyajikan warna coklat atau coklat. Jika jumlah N tertentu disuntikkan ke dalam botol atau wadah kecil2SALAH SATU4, Ini tidak akan berwarna sampai keseimbangan ditetapkan.
Di sebelah kiri gambar atas, dapat dilihat bahwa hampir semua molekul dari N2SALAH SATU4 dan bahwa konsentrasi no2 Itu nol.
Tunjukkan juga dua grafik yang mewakili seperti apa tren keseimbangan, dengan garis putus -putus menunjukkan posisi pada saat hanya n yang disuntikkan2SALAH SATU4. Grafik sesuai dengan konsentrasi vs. Waktu (tangan ke bawah) dan yang lainnya sesuai dengan grafik dengan kecepatan vs. Waktu (tangan kanan).
Konsentrasi n2SALAH SATU4, [N2SALAH SATU4] (garis biru) akan berkurang secara bertahap, karena sebagian akan dipisahkan untuk menghasilkan molekul NO2. Dengan demikian, menjadi konsentrasi NO2, [TIDAK2] (garis merah) sama dengan nol di awal, akan segera meningkat karena n2SALAH SATU4 Memisahkan.
Namun, ini adalah reaksi reversibel: bagian dari molekul NO2 Mereka akan bergabung untuk membentuk n2SALAH SATU4. Oleh karena itu, akan ada dua reaksi, langsung dan terbalik, masing -masing dengan kecepatannya sendiri.
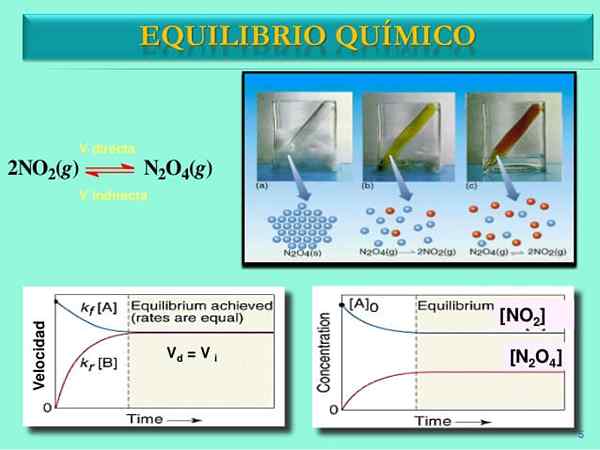 Sumber: SlideShare.bersih
Sumber: SlideShare.bersih Kecepatan reaksi
Pada awalnya, kecepatan konsumsi n2SALAH SATU4 lebih besar dari kecepatan konsumsi no2. Jelas, hanya memiliki n2SALAH SATU4, Beberapa molekul yang terbentuk dari no2 Mereka hampir tidak dapat menemukan diri mereka bereaksi. Pada titik ini, botol akan mulai menggelitik oranye, karena ada campuran n2SALAH SATU4 dan tidak2.
Sedikit demi sedikit, karena ada lebih banyak molekul no2 Di jalan dan molekul N itu2SALAH SATU4 Mereka memisahkan, kecepatan kedua reaksi akan cocok, bahkan jika konsentrasi berbeda satu sama lain. Itu, tidak2] cenderung lebih besar dari [n2SALAH SATU4], itulah sebabnya garis merah berada di atas garis kebiruan.
Dapat melayani Anda: sifat fisikokimiaPerhatikan bahwa kecepatan menjadi DC/DT, yaitu perubahan konsentrasi sehubungan dengan waktu. Itulah sebabnya keduanya C VS. t dan V Vs. t tidak identik.
Pada keseimbangan
Setelah pasangan n2SALAH SATU4-TIDAK2 Tetapkan keseimbangan, kecepatan kedua reaksi akan dicocokkan dan ekspresi matematika berikut akan diperoleh:
Vlangsung = k1[N2SALAH SATU4]
Vbalik = k-1[TIDAK2]2
Vlangsung = Vbalik
k1[N2SALAH SATU4] = k-1[TIDAK2]2
k1/k-1 = [Tidak2]2/ [N2SALAH SATU4]
KPersamaan = [Tidak2]2/ [N2SALAH SATU4]
Pada titik ini, jalan akan dicat bahkan lebih dari cokelat, karena keseimbangan lebih terlantar ke pembentukan [tidak2]. Yaitu kPersamaan, Konstanta kesetimbangan harus lebih besar dari 1 dengan mempertimbangkan hubungan yang lebih tinggi, [tidak2]2/ [N2SALAH SATU4].
Dalam konsentrasi keseimbangan [n2SALAH SATU4] dan tidak2] Mereka tetap konstan, dengan kedua reaksi terjadi pada kecepatan yang sama: sejumlah N hanya dipisahkan2SALAH SATU4, Jumlah yang sama akan segera diproduksi karena reaksi dari jumlah NO tertentu2.
Untuk alasan ini, dikatakan bahwa keseimbangan kimianya dinamis: molekul n2SALAH SATU4 dan tidak2 Mereka masih berpartisipasi dalam reaksi bahkan ketika tidak ada perubahan dalam konsentrasi mereka.
Dan menjadi kecepatan reaksi yang sama untuk kedua indera, garis merah dan kebiruan dalam grafik V Vs. t mainkan di garis horizontal.
Konstanta keseimbangan
Konstanta kesetimbangan untuk reaksi sebelumnya akan selalu sama, pada suhu tertentu, terlepas dari berapa banyak n2SALAH SATU4 disuntikkan di awal ke jalan. Ini akan terjadi bahkan jika campuran n secara langsung disuntikkan2SALAH SATU4 dan tidak2, Kemudian dibiarkan istirahat sampai keseimbangan mencapai.
Saat keseimbangan tercapai dan konsentrasi diukur [n2SALAH SATU4] dan tidak2], hubungan [tidak2]2/ [N2SALAH SATU4] akan memberikan hal yang sama untuk kPersamaan Untuk reaksi ini. Semakin besarnya (Keq >> 1), semakin banyak produk yang akan seimbang. Dan yang lebih kecil (Keq << 1), más reactivos habrá en el equilibrio.
Konsentrasi [n2SALAH SATU4] dan tidak2] Mereka tidak akan selalu. Misalnya, jika volume kecil disuntikkan ke dalam botol, atau jika sebaliknya mereka disuntikkan torrent gas ini ke dalam reaktor, jumlahnya akan sangat bervariasi. Namun, kPersamaan Itu akan tetap sama selama suhunya sama di kedua proses.
KPersamaan Itu rentan terhadap perubahan suhu: pada suhu yang lebih tinggi, nilai yang lebih besar akan. Yaitu pada suhu yang lebih tinggi, dalam keseimbangan akan cenderung untuk pembentukan lebih banyak produk. Ini kecuali jika reaksinya eksotermik, seperti yang akan dijelaskan di bagian berikut.
Faktor yang mempengaruhi keseimbangan kimia
Faktor -faktor yang mempengaruhi keseimbangan kimia dalam reaksi reversibel adalah: konsentrasi, tekanan dan suhu.
- Konsentrasi
Dalam reaksi reversibel, menurut prinsip Le Chatlier, dengan meningkatkan konsentrasi reagen akan ada perpindahan keseimbangan kimia ke kanan, untuk meningkatkan konsentrasi produk reaksi produk reaksi.
Sebaliknya, jika suatu produk ditambahkan ke reaksi, keseimbangan kimia akan bergerak ke kiri, untuk meningkatkan konsentrasi reagen. Jika reaksi berikut diambil sebagai contoh:
C (S) +O2(g) ⇌ 2 co (g)
Dengan meningkatkan konsentrasi reagen (c dan o2), Keseimbangan akan bergerak ke kanan, yaitu, menuju pembentukan produk karbon monoksida (CO) (CO). Tetapi peningkatan konsentrasi CA akan menghasilkan perpindahan keseimbangan ke kiri, untuk meningkatkan konsentrasi C dan O2.
Ini dapat melayani Anda: Grup Karbonil: Karakteristik, Properti, Nomenklatur, Reaktivitas- Tekanan
Dalam reaksi yang dikembangkan dalam fase gas, variasi dalam volume atau dalam tekanan yang diberikan pada gas yang terlibat di dalamnya, akan menghasilkan perubahan dalam keseimbangan, tergantung pada jumlah mol reagen dan produk.
Jika komponen reaksi (reagen dan produk) memiliki perbedaan dalam jumlah mol yang terlibat dalam suatu reaksi, misalnya, dimerisasi nitrogen dioksida (NO2):
2 tidak2(g) ⇌2SALAH SATU4(G)
Peningkatan tekanan yang diberikan pada reaksi dalam fase gas, konsekuensi dari penurunan atau tidak dari volume reaksi, akan menyebabkan perpindahan keseimbangan kimia ke sisi yang memiliki lebih sedikit mol gas gas. Dalam contoh ini: Produk n2SALAH SATU4.
Sebaliknya, penurunan tekanan akan menghasilkan perpindahan keseimbangan ke sisi reaksi yang memiliki jumlah mol gas terbesar. Dalam contoh yang diberikan, itu akan bergerak menuju reagen (tidak2), Untuk menangkal penurunan tekanan.
Jika dalam reaksi fase soda, mol reagen sama dengan mol produk, perubahan tekanan tidak akan mempengaruhi keseimbangan kimia.
- Suhu
Reaksi endotermik
Dalam reaksi endotermik, panas dapat dianggap sebagai reagen, karena pasokannya diperlukan agar reaksi terjadi:
A +q ⇌ b
Q = panas disediakan
Oleh karena itu, dalam reaksi endotermik ketika suhu meningkat, keseimbangan akan bergerak ke kanan. Sementara itu, ketika suhu menurun, keseimbangan bergerak ke kiri.
Panas menjadi bagian dari reagen, untuk mengkonsumsinya untuk berubah menjadi b.
Reaksi eksotermik
Dalam reaksi eksotermik, panas dihasilkan, ini menjadi produk dari reaksi:
A ⇌ B +Q
Dalam reaksi eksotermik ketika suhu meningkat, keseimbangan akan bergerak ke kiri (reagen), karena produksi panas meningkat. Sementara itu, ketika suhu menurun, keseimbangan akan bergerak ke kanan (produk).
Panas menjadi bagian dari produk, ketika suhu meningkat tidak perlu berkontribusi lebih banyak panas ke lingkungan. Dan karena itu, keseimbangan akan berupaya memanfaatkan panas ekstra untuk menghasilkan lebih banyak reagen; Dalam hal ini, lebih dari.
Jenis keseimbangan kimia
Bergantung pada keadaan fisik komponen reaksi, keseimbangan kimia bisa homogen atau heterogen.
Keseimbangan homogen
Dalam jenis keseimbangan ini, semua Reagen dan produk memiliki fase atau status cair yang sama. Misalnya:
N2(g) +3 h2(g) ⇌ 2 nh3(G)
Ini dia2, seperti h2 dan NH3 Mereka adalah zat gas.
Keseimbangan heterogen
Ada kapan tidak semua Reagen dan produk memiliki fase atau kondisi fisik yang sama. Misalnya:
2 Nahco3(s) ⇌ na2BERSAMA3(s) +co2(g) +h2O (g)
Di sini kita memiliki nahco3 dan na2BERSAMA3 sebagai padatan, dan co2 dan H2Atau sebagai gas atau uap.
Contoh keseimbangan kimia
Disosiasi asam asetat dalam air
Asam Asetat, Cho3CoOH, Disosiasi dalam air yang menetapkan keseimbangan:
Ch3CoOH (ac) + h2Atau (l) ⇌ cho3Mendekut-(Ac) + h3SALAH SATU+(AC)
Reaksi yang konstanta keseimbangannya disebut konstan keasaman.
Isomerisasisalah satun dari butana
Gas N-Butano dapat diisomerisasi sesuai dengan reaksi reversibel berikut untuk menghasilkan isomer isomer:
Ch3Ch2Ch2Ch3(g) ⇌ cho3Ch (ch3)2(G)
Pembentukan oksida nitrat di atmosfer
Di atmosfer, oksida nitrat dapat terbentuk, meskipun hampir tidak, dari nitrogen dan oksigen udara:
N2(g) + atau2(g) ⇌ 2no (g)
Itu bisa melayani Anda: apa miliequivalente? (Contoh perhitungan)KPersamaan Dari reaksi ini adalah 2 · 10-31 pada 25 ºC, jadi jumlah yang tercela dari tidak akan terbentuk.
Reaksisalah satuN komproduksi perak dengan amonyoAc
Ion perak, AG+, Mereka dapat diselesaikan dengan amonia sesuai dengan reaksi reversibel berikut:
Ag+(Matahari) + 2nh3(L) ⇌ [Ag (NH3)2]+(matahari)
Latihan terpecahkan
Latihan 1
Jenis keseimbangan kimia apa yang sesuai dengan reaksi berikut?
2nocl (g) ⇌ 2no (g) + cl2(G)
Reaksi ini sesuai dengan keseimbangan homogen, karena semua zat yang terlibat, NOCL, NO dan CL2, Mereka adalah gas.
Latihan 2
Untuk reaksi yang sama dari atas, perubahan keseimbangan apa yang bisa diharapkan jika tekanan tiba -tiba meningkat?
Mari kita hitung mol reagen:
2nocl
Kami memiliki 2 mol NOCL. Sekarang mari kita beri tahu mol produk:
2No + Cl2
Kami memiliki tiga tahi lalat: dua dari no, dan satu dari cl2. Ada lebih banyak mol gas di sisi produk. Oleh karena itu, peningkatan tekanan akan menyebabkan keseimbangan bergerak ke sisi kiri, menuju pembentukan NOCL. Dengan cara ini, sistem berupaya melunakkan efek tekanan yang mendukung pembentukan NOCL dan bukan dari no dan cl2.
Latihan 3
Untuk reaksi yang sama dari atas, misalkan volume CL yang cukup besar tiba -tiba disuntikkan2. Apa yang akan terjadi untuk menyeimbangkan?
Saat menambahkan Cl2 ke reaktor atau wadah, konsentrasinya meningkat sebagai produk dari reaksi. Dan oleh karena itu, keseimbangan akan bergerak kembali ke kiri, untuk membentuk lebih banyak NOCL.
Latihan 4
Jika disosiasi NOCL pada 227 ºC memiliki konstanta 4 kesetimbangan 4.5 · 10-4, Ke arah mana keseimbangan menggeser?
Sekali lagi, menjadi kPersamaan kurang dari 1 (4.5 · 10-4 < 1), en el equilibrio se espera que haya más NOCl que NO o Cl2, karena dipindahkan ke kiri.
Latihan 5
Menurut reaksi berikut dalam keseimbangan:
[CO (oh2)6]2+(Ac) +4cl-(Ac) +q ⇌ [cocl4]2-(Ac) +6h2Atau (l)
Dan mengetahui bahwa kompleks [co (oh2)6]2+ Warnanya merah muda, dan kompleksnya [cocl4]2- Itu kebiruan, perubahan apa yang akan Anda harapkan untuk melihat apakah Anda memanaskan wadah dengan [co (oh2)6]2+? Apa yang ingin Anda lihat jika setelah memanaskan wadah saya akan menempatkannya di kamar mandi dengan es?
Reaksinya adalah endotermik, karena menyerap panas yang sebagai reagen. Oleh karena itu, saat memanaskan wadah dengan [CO (oh2)6]2+, Keseimbangan akan bergerak ke kanan, menuju pembentukan [cocl4]2-. Perubahan warna merah muda kebiruan akan terjadi.
Lalu, jika wadah pewarnaan kebiruan dengan [cocl4]2- Itu ditempatkan di kamar mandi dengan es, reaksinya sekarang akan bergerak ke kiri, menuju pembentukan CO (oh2)6]2+:
[Cocl4]2-(Ac) +6h2Atau (l) ⇌ [co (oh2)6]2+(Ac) +4cl-(Ac) +q
Ini karena reaksi terbalik adalah eksotermik, memiliki panas yang sebagai produk. Oleh karena itu, saat mendinginkan wadah dengan [cocl4]2- Biru, kompleks [co (oh (oh2)6]2+, Dan warna merah muda akan muncul kembali.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Persiapan emedis. (S.F.). Jenis keseimbangan. Pulih dari: emedicprep.com
- Kimia Tanpa Batas Lumen. (S.F.). Faktor -faktor yang sesuai dengan keseimbangan kimia. Pulih dari: kursus.Lumenarning.com
- Wikipedia. (2020). Keseimbangan kimia. Diperoleh dari: di.Wikipedia.org
- Libretteks Kimia. (24 Mei 2020). Perhitungan Equiquibrium - Sub Illustrative Examplies. Pulih dari: chem.Librettexts.org
- Meyers Amy. (2020). Keseimbangan: Kimia dan Dinamika. Belajar. Pulih dari: belajar.com
- Helmestine, Anne Marie, PH.D. (11 Februari 2020). Keseimbangan kimia dalam reaksi kimia. Pulih dari: thinkco.com
- « Karakteristik budaya, tradisi, dan kebiasaan Guatemala
- Elektroforesis fondasi, teknik, untuk apa, contohnya »

