Skala Pauling

- 1195
- 28
- Miss Marion Graham
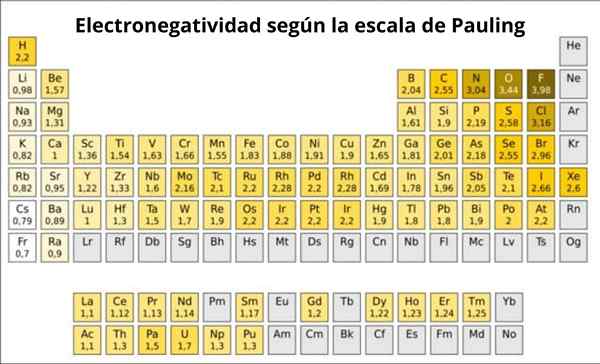 Gambar 1. Skala Pauling. Sumber: Wikimedia Commons.
Gambar 1. Skala Pauling. Sumber: Wikimedia Commons. Apa itu skala Pauling?
Itu Skala Pauling Ini adalah skala sewenang -wenang yang digunakan dalam kimia untuk mengekspresikan Elektronegativitas elemen -elemennya. Ini didefinisikan sebagai kecenderungan atom tertentu untuk menarik elektron saat dikombinasikan dengan atom lain.
Dalam hal ini, elemen elektronegativitas yang tinggi cenderung mendapatkan elektron dengan mudah. Ini adalah non -logam, sedangkan untuk bagian mereka, semakin sedikit elemen elektronegatif seperti logam, lebih mudah bagi mereka untuk menghasilkan elektron.
Oleh karena itu, mengetahui elektronegativitas suatu elemen memiliki gagasan tentang jenis tautan yang mampu dibentuk saat dikombinasikan dengan yang lain. Kami akan melihat ini dengan contoh numerik nanti.
Dengan informasi ini, Anda dapat memprediksi banyak sifat yang dimiliki suatu senyawa, sesuatu yang sangat berguna dalam kimia eksperimental dan untuk ilmu material, di mana senyawa baru terus dibuat.
Namun, lebih mudah untuk mengklarifikasi bahwa terlepas dari betapa pentingnya itu, tidak ada cara unik untuk menentukan elektronegativitas; Skala Pauling hanyalah salah satu dari berbagai bentuk yang diusulkan untuk menemukannya, meskipun merupakan salah satu yang paling banyak digunakan.
Faktanya, Pauling adalah skala sewenang -wenang di mana nilai numerik ditetapkan untuk setiap elemen dari tabel periodik, yang mencerminkan elektronegativitasnya. Kami melihatnya pada Gambar 1, di mana Anda memiliki elektronegativitas dari masing-masing elemen, seperti yang ditugaskan oleh Hadiah Nobel dua kali Linus Pauling (1901-1994) sekitar tahun 1939.
Elektronegativitas elemen
Pauling, di sebelah Don M. Yost, menemukan nilai elektronegativitas secara empiris, melalui data eksperimental yang diperoleh dengan mengukur energi tautan.
Pauling ditugaskan ke fluor.0. Jadi, ketika fluoride membentuk tautan, itu menunjukkan tren tertinggi untuk menarik elektron di antara semua elemen.
Itu dapat melayani Anda: Nomor Koordinasi: Apa itu, Perhitungan, ContohKedua adalah oksigen, dengan 3.5 dan ketiga adalah nitrogen dengan 3.0. Keduanya terletak di atas dan di sebelah kanan meja.
Di sisi lain, di ujung yang berlawanan, elemen elektronegatif paling sedikit adalah cesium, yang simbolnya adalah CS, terletak di sebelah kiri meja, yang Pauling tetapkan angka 0.7.
Elektronegativitas dalam tabel periodik
Secara umum dan seperti yang diamati pada Gambar 1, elektronegativitas - dan energi ionisasi - meningkat dari kiri ke kanan dalam tabel periodik. Tren umum juga menunjukkan penurunan saat bergerak dari atas ke bawah.
Oleh karena itu elemen yang paling elektronegatif akan memilikinya di sudut kanan atas tabel: fluor, oksigen, klorin, nitrogen. Elektronegatif terkecil atau yang paling elektropositif jika mereka lebih disukai -akan berada di sebelah kiri: lithium, natrium, kalium dan elemen lain dari kelompok 1 -kolom kiri ekstrem, sesuai dengan logam alkali dan alkali alkali-.
Di setiap kolom, elektronegativitas berkurang dengan meningkatkan jumlah atom elemen, kecuali dalam logam transisi di tengah, yang tidak mengikuti tren ini.
Poin penting yang harus disorot adalah bahwa elektronegativitas adalah relatif, itu bukan properti yang tidak berubah -ubah dari setiap elemen, dan hanya diukur sehubungan dengan elemen lain. Itu sangat tergantung pada keadaan oksidasi, sehingga elemen yang sama dapat menunjukkan elektronegativitas yang berbeda, tergantung pada jenis senyawa yang membentuk.
Link Perbedaan Energi
 Gambar 2. AMERIKA AMERIKA Linus Pauling pada tahun 1955. Sumber: Wikimedia Commons.
Gambar 2. AMERIKA AMERIKA Linus Pauling pada tahun 1955. Sumber: Wikimedia Commons. Dalam kimia, tautan adalah cara di mana atom bergabung, sama atau berbeda, untuk membentuk molekul. Di antara atom adalah kekuatan yang membuat mereka tetap stabil.
Ada beberapa jenis tautan, tetapi dua dipertimbangkan di sini:
- Kovalen, di mana atom elektronegativitas serupa berbagi beberapa elektron.
- Ionik, Sering antara atom dengan elektronegatif yang berbeda di mana daya tarik elektrostatik berlaku.
Misalkan dua elemen A E B dapat membentuk molekul satu sama lain, dilambangkan AA dan BB. Dan mereka juga dapat bergabung untuk membentuk kompleks AB, semua melalui beberapa jenis tautan.
Berkat partisipasi kekuatan antarmolekul, ada energi dalam tautan. Misalnya energi di tautan AA adalah EA A, Di tautan BB adalah Ebb dan akhirnya di Compound AB adalah EAB.
Jika molekul AB akan dibentuk oleh ikatan kovalen, secara teoritis energi tautan adalah rata -rata energi danA A dan eBb:
DANAB = ½ (eA A + DANBb)
Pauling menghitung eAB Untuk beberapa senyawa, mengukurnya secara eksperimental dan menentukan perbedaan antara kedua nilai, yang disebut Δ:
Δ = | (eAB) diukur - (eAB) Teoretis | = | (EAB) diukur - ½ (eA A + DANBb) |
Pauling beralasan seperti ini: jika Δ sangat dekat dengan 0, itu berarti bahwa elektronegativitas dari kedua elemen itu serupa dan tautan yang menyatukannya adalah kovalen. Tetapi jika Δ tidak kecil, maka hubungan antara A dan B bukan kovalen murni.
Semakin besar nilai absolut δ, semakin besar perbedaan antara elektronegativitas elemen A dan B dan oleh karena itu tautan yang tidak akan menjadi tipe ionik. Kemudian pembaca akan menemukan contoh di mana, menghitung Δ, dimungkinkan untuk menentukan jenis tautan suatu senyawa.
Persamaan untuk elektronegativitas
Mulai dari fakta bahwa perbedaan energi adalah sinyal yang membedakan sifat hubungan, Pauling melakukan banyak percobaan yang membuatnya menciptakan ekspresi empiris untuk elektronegatif relatif dari dua elemen ke E B yang membentuk molekul.
Dengan menunjukkan elektronegativitas seperti χ (huruf Yunani "chi"), Pauling mendefinisikan δ sebagai berikut:
F2· Δ = [χ (a) - χ (b)]2
χ (a) - χ (b) = f√Δ = 0.102√Δ
Dapat melayani Anda: Tanteo Balance: Langkah, Contoh dan LatihanPerhatikan bahwa δ adalah jumlah positif. Fatia f = 0.102 yang muncul mengalikan akar kuadrat Δ adalah faktor konversi antara KJ (kilojoule) dan EV (elektron-volt), kedua unit energi.
Jika sebaliknya kilokalorori dan volt elektron digunakan, perbedaan elektronegativitas diekspresikan dengan rumus yang sama tetapi dengan f = 0.208:
χ (a) - χ (b) = 0.208 Dinding
Pauling mulai menugaskan hidrogen nilai 2.1, nilai sebelumnya yang diperoleh oleh ahli kimia Robert Mulliken. Dia memilih elemen ini sebagai titik awal karena membentuk tautan kovalen dengan banyak orang lain.
Melalui persamaan sebelumnya, ia terus memberikan nilai yang terkait dengan sisa elemen. Itu menyadari bahwa elektronegativitas meningkat ketika bergerak dari kiri ke kanan dan dari atas ke bawah dalam tabel periodik, seperti yang dijelaskan pada bagian sebelumnya.
Contoh
Di bawah ini adalah daftar elemen: n, j, dan m dan elektronegativitas masing -masing χ sesuai dengan skala Pauling:
-N: Χ = 4.0
-J: Χ = 1.5
-DAN: Χ = 0.9
-M: Χ = 1.6
Di antara senyawa berikut yang dibentuk dengan mereka:
Yj, yn, mn dan jm
Tunjukkan yang dengan karakter ionik terbesar dan yang sifatnya kovalen. Alasan jawaban Anda.
Larutan
Menurut kriteria yang ditetapkan oleh Pauling, senyawa dengan karakter ionik tertinggi akan menjadi yang memiliki perbedaan terbesar antara elektronegatifitas, dan oleh karena itu nilai Δ yang lebih besar. Untuk bagiannya, senyawa dengan perbedaan energi terendah adalah yang memiliki ikatan kovalen.
Kemudian kita akan menghitung berapa banyak δ yang bernilai untuk setiap senyawa, sebagai berikut:
Compound YJ
Δ = [χ (y) - χ (j)]2 = (0.9 - 1.5)2 = 0.36
Senyawa yn
Δ = [χ (y) - χ (n)]]2 = (0.9 - 4.0)2 = 9.61
Senyawa mn
Δ = [χ (m) - χ (n)]2 = (1.6 - 4.0)2 = 5.76
Senyawa jm
Δ = [χ (j) - χ (m)]2 = (1.5 - 1.6)2 = 0.01
Dari hasil di atas, maka senyawa karakter ionik adalah Yn, yang Δ = 9.61, sedangkan senyawa karakter kovalen adalah JM, dengan Δ = 0.01.

