Struktur tersier fitur karakteristik utama

- 1798
- 19
- Leland Robel
Itu Struktur protein tersier Ini adalah konformasi tiga dimensi yang diperoleh rantai polipeptida saat melipat pada diri mereka sendiri. Konformasi ini muncul dengan interaksi antara rantai lateral dari limbah asam amino dari polipeptida. Rantai samping dapat berinteraksi secara independen dari posisi mereka dalam protein.
Karena itu tergantung pada interaksi antara kelompok R, struktur tersier menunjukkan aspek non -revetitif dari rantai, karena kelompok ini berbeda untuk setiap residu asam amino. Struktur sekunder, di sisi lain, tergantung pada gugus karboksil dan amino, yang ada di semua asam amino.
 Struktur tersier protein kinase fosfatase, dengan struktur sekunder dalam daun alfa dan beta. Diambil dan diedit dari: A2-33. Dimodifikasi oleh alejandro porto. [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)].
Struktur tersier protein kinase fosfatase, dengan struktur sekunder dalam daun alfa dan beta. Diambil dan diedit dari: A2-33. Dimodifikasi oleh alejandro porto. [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)].
Beberapa penulis menyarankan bahwa protein berserat memiliki struktur tersier sederhana, namun demikian, penulis lain menunjukkan bahwa struktur ini khas dari protein globular.
[TOC]
Protein berserat
Pada protein berserat, rantai polipeptida disusun dalam bentuk filamen panjang atau lembaran panjang; Mereka umumnya terdiri dari jenis struktur sekunder yang unik. Struktur sekunder ini, dalam banyak kasus, lebih penting daripada struktur tersier dalam menentukan bentuk protein.
Fungsi biologisnya bersifat struktural, memberikan kekuatan dan/atau elastisitas pada organ dan struktur di mana mereka ditemukan, sambil menjaga mereka tetap bersama. Semua protein berserat tidak larut dalam air, karena jumlah besar asam amino hidrofobik yang mereka hadapi.
Di antara protein berserat ini adalah keratin dan kolagen. Yang pertama ditemukan dalam kain konjungtif dan dalam struktur seperti rambut, kuku (α-queratinas), timbangan dan bulu (β-cheatin). Kolagen, sementara itu, ditemukan dalam tulang, tendon dan kulit, antara lain.
α-queratinas
Protein ini adalah bagian dari protein filamen perantara yang disebut SO, yang memainkan peran penting dalam sitoskeleton organisme multiseluler. Selain itu, mereka adalah konstituen utama rambut, kuku, wol, tanduk, kuku, dan salah satu protein kulit hewan utama.
Dapat melayani Anda: pewarnaan KinyounStruktur molekul adalah baling -baling α. Dua untaian α-queratin dapat diatur secara paralel dan mendaftar satu sama lain dengan kelompok hidrofobik R yang berinteraksi di antara mereka. Dengan cara ini struktur superhelik atau bola dibuat dengan belitan di sebelah kiri.
Struktur tersier α keratin sederhana dan didominasi oleh struktur sekunder α-helix. Di sisi lain, struktur kuaterner juga ada, karena dua molekul berpartisipasi dalam struktur superhelicoidal, yang berinteraksi melalui ikatan non -kovalen.
β-queratinas
Struktur primer mirip dengan α-queratinas, tetapi struktur sekundernya didominasi oleh lembaran β. Mereka adalah konstituen utama skala reptil dan bulu burung.
Kolagen
Protein ini dapat mewakili lebih dari 30% dari total massa protein dari beberapa hewan. Itu ditemukan di cartilagos, tulang, tendon, kornea dan kulit, di antara jaringan lainnya.
Struktur sekunder kolagen adalah unik, diwakili oleh baling -baling levogira dengan 3,3 limbah asam amino untuk setiap putaran. Tiga Rantai Baling Levogyous (α).
Molekul tropokollagen berkumpul untuk membentuk serat kolagen yang memiliki resistensi yang besar, lebih tinggi dari baja dan sebanding dengan tembaga resistansi tinggi.
Protein berserat lainnya
Jenis protein berserat lainnya adalah fibroine dan elastin. Yang pertama dibentuk oleh lembaran β, terutama dibentuk oleh glycina, alanin dan serin.
Rantai lateral asam amino ini kecil, sehingga mereka dapat dikemas dengan cermat. Hasilnya adalah serat yang sangat resisten dan sangat tidak terpelajar.
Dapat melayani Anda: fosfat buffer (PBS): fondasi, persiapan dan penggunaanDi elastin, sementara itu, valin menggantikan serin di antara asam amino konstituen utamanya. Tidak seperti fibroine, elastin sangat dapat diperluas, karenanya namanya. Dalam konstitusi molekul, lisin juga bertindak, yang dapat berpartisipasi dalam ikatan silang yang memungkinkan elastin memulihkan bentuknya ketika ketegangan berhenti.
Protein globular
Protein globular, tidak seperti berserat, larut dan umumnya memiliki beberapa jenis struktur sekunder. Namun, dalam hal ini adalah konformasi tiga dimensi yang lebih penting yang mereka peroleh saat melipat diri mereka sendiri (struktur tersier).
Konformasi tiga -dimensi khusus ini memberikan aktivitas biologis spesifik untuk setiap protein. Fungsi utama protein ini adalah peraturan, seperti halnya enzim.
Karakteristik struktur tersier protein globular
Struktur tersier protein globular memiliki beberapa karakteristik penting:
- Protein globular kompak berkat kemasan saat rantai polipeptida melipat.
- Limbah asam amino yang jauh dalam struktur utama rantai polipeptida dekat, mampu berinteraksi satu sama lain karena lipat.
- Protein globular yang lebih besar (lebih dari 200 asam amino) dapat memiliki beberapa segmen kompak, independen di antara mereka dan dengan fungsi tertentu, dan masing -masing segmen ini disebut domain. Domain dapat memiliki antara 50 dan 350 limbah asam amino.
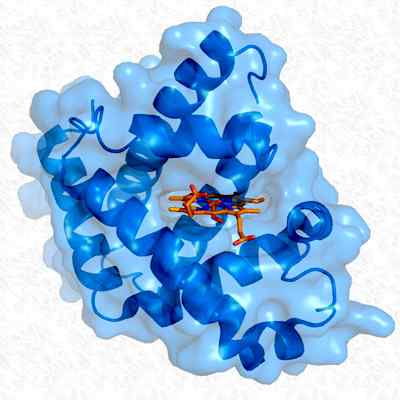 Struktur mioglobin tersier. Diambil dan diedit dari: Thomas Splettstoesser. Dimodifikasi oleh alejandro porto. [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)].
Struktur mioglobin tersier. Diambil dan diedit dari: Thomas Splettstoesser. Dimodifikasi oleh alejandro porto. [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)].
Aturan Umum Lipat Protein Global
Seperti yang telah dicatat, protein memiliki bentuk lipat tertentu, yang memberi mereka juga karakteristik tertentu. Lipat ini tidak acak dan disukai baik oleh struktur primer dan sekunder dan oleh beberapa interaksi non -kovalen, dan ada juga beberapa pembatasan fisik untuk lipat, sehingga beberapa aturan telah dirumuskan:
Dapat melayani Anda: organ limfoid primer- Semua protein globular memiliki pola distribusi yang ditentukan, dengan gugus hidrofobik diarahkan ke dalam molekul dan limbah hidrofilik di lapisan luar di lapisan luar. Untuk ini, setidaknya dua lapisan struktur sekunder diperlukan. Loop β-α-β dan α-α vertex dapat berkontribusi kedua lapisan tersebut.
- Lembaran β umumnya diatur dalam bentuk levogira rolled.
- Dalam rantai polipeptida, belokan yang berbeda dapat terjadi bergerak dari struktur sekunder ke struktur lain, seperti β atau γ belokan, yang dapat menginvestasikan arah rantai menjadi empat limbah asam amino atau kurang.
- Protein globular memiliki α, β sheet, tikungan dan segmen yang terstruktur secara tidak teratur.
Denaturasi protein
Jika protein kehilangan struktur tiga dimensi asli (alami), ia kehilangan aktivitas biologisnya dan sebagian besar sifat spesifiknya. Proses ini dikenal sebagai denaturasi.
Denaturasi dapat terjadi ketika kondisi lingkungan alami berubah, misalnya dengan berbagai suhu atau pH. Proses ini tidak dapat diubah dalam banyak protein; Namun, yang lain dapat secara spontan memulihkan struktur alami mereka dengan memulihkan kondisi lingkungan normal.
Referensi
- C.K. Mathews, k.DAN. Van Hold & K.G. Ahern (2002). Biokimimia. Edisi ke -3. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, hlm. Mayes, d.C. Granner & v.W. Rodwell (1996). Harper's Biochemery. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko & l. Stryer (2002). Biokimimia. Edisi ke -5. W. H. Freeman and Company.
- W.M. Becker, l.J. Kleinsmith & J. Hardin (2006) World of the Cell. Edisi ke -6. Pearson Education Inc.
- KE.Lehninger (1978). Biokimia. Edisi omega, s.KE.
- T. McKee & J.R. McKee (2003). Biokimia: Dasar Kehidupan Molekuler. Edisi ke -3. The McGraw-Hiii Companies, Inc.
- « Sifat kondensat fermionik, aplikasi dan contoh
- Struktur Dodecil Sodium Sulfate (SDS), Properti, Penggunaan »

