Faktor kompresibilitas cara menghitung, contoh dan latihan
- 2472
- 707
- Ernesto Mueller
Dia Faktor kompresibilitas z, o Faktor kompresi untuk gas, adalah nilai tanpa dimensi (tanpa unit) yang diperkenalkan sebagai koreksi dalam persamaan status gas ideal. Dengan cara ini model matematika lebih mirip dengan perilaku gas yang diamati.
Dalam gas ideal, persamaan keadaan yang berhubungan dengan variabel P (tekanan), V (volume) dan t (suhu) adalah: P.V ideal = n.R.T dengan n = jumlah mol dan r = konstanta gas ideal. Menambahkan koreksi faktor pengompresi z, persamaan ini diubah menjadi:
P.V = z.N.R.T
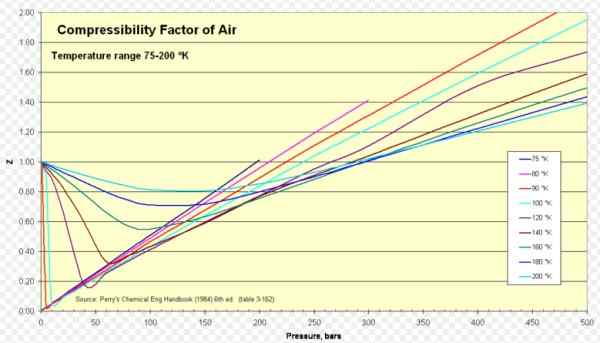
 Gambar 1. Faktor kompresibilitas udara. Sumber: Wikimedia Commons. https: // unggah.Wikimedia.org/wikipedia/commons/8/84/compressibility_factor_of_air_75-200_k.Png.
Gambar 1. Faktor kompresibilitas udara. Sumber: Wikimedia Commons. https: // unggah.Wikimedia.org/wikipedia/commons/8/84/compressibility_factor_of_air_75-200_k.Png. [TOC]
Cara menghitung faktor kompresibilitas?
Dengan mempertimbangkan volume molar itu VDingin = V/n, Anda memiliki volume molar nyata:
P . Vnyata = Z. R. T → Z = PV nyata/Rt
Karena faktor kompresibilitas Z tergantung pada kondisi gas, ia dinyatakan sebagai fungsi tekanan dan suhu:
Z = z (p, t)
Membandingkan dua persamaan pertama, dicatat bahwa jika jumlah mol n sama dengan 1, volume molar gas asli terkait dengan gas ideal melalui:
Vnyata / Videal = Z → v nyata = Z videal
Ketika tekanan melebihi 3 atmosfer, sebagian besar gas berhenti berperilaku sebagai gas ideal dan volume nyata berbeda secara signifikan dari yang ideal.
Ini direalisasikan dalam eksperimennya fisikawan Belanda Johannes van der Waals (1837-1923), yang membawanya membuat model yang lebih baik disesuaikan dengan hasil praktis daripada persamaan gas ideal: persamaan keadaan van der Waals.
Dapat melayani Anda: natrium oksalat (na2c2o4): struktur, sifat, penggunaan, risikoContoh
Menurut persamaan P.Vnyata= Z.N.Rt, Untuk gas yang ideal, z = 1. Namun, dalam gas nyata, dengan meningkatkan tekanan juga melakukan nilai z. Ini masuk akal karena pada molekul gas tekanan yang lebih besar memiliki lebih banyak peluang untuk bertabrakan, oleh karena itu kekuatan tolakan meningkat dan dengan demikian volume.
Di sisi lain untuk menurunkan tekanan, molekul bergerak dengan kebebasan yang lebih besar dan kekuatan tolakan menurun. Oleh karena itu volume yang lebih rendah diharapkan. Adapun suhu, saat meningkat, z berkurang.
Seperti yang diamati Van der Waals, di sekitar titik kritis yang disebut SO, perilaku gas sangat dialihkan dari gas yang ideal.
Titik kritis (tC, PC) zat apa pun adalah nilai tekanan dan suhu yang menentukan perilaku mereka sebelum perubahan fase:
-TC Itu adalah suhu di atas yang gas yang dimaksud tidak dicairkan.
-PC Ini adalah tekanan minimum yang diperlukan untuk mencairkan gas pada suhu tC
Namun, setiap gas memiliki titik kritisnya sendiri, mendefinisikan suhu dan mengurangi tekanan tR Dan pR sebagai berikut:
PR = P / pC
VR = V /vC
TR = T /tC
Diamati bahwa gas yang dibatasi dengan identik VR Dan TR memberikan tekanan yang sama PR. Untuk alasan ini, jika Z adalah grafik tergantung pada PR untuk hal yang sama TR, Setiap titik dalam kurva itu sama untuk gas apa pun. Ini disebut Prinsip negara yang sesuai.
Faktor kompresibilitas dalam gas ideal, udara, hidrogen dan air
Di bawah ini adalah kurva kompresibilitas untuk berbagai gas pada berbagai suhu berkurang. Kemudian beberapa contoh z untuk beberapa gas dan prosedur untuk menemukan z dengan menggunakan kurva.
Dapat melayani Anda: Hidrogen: Sejarah, Struktur, Sifat dan Penggunaan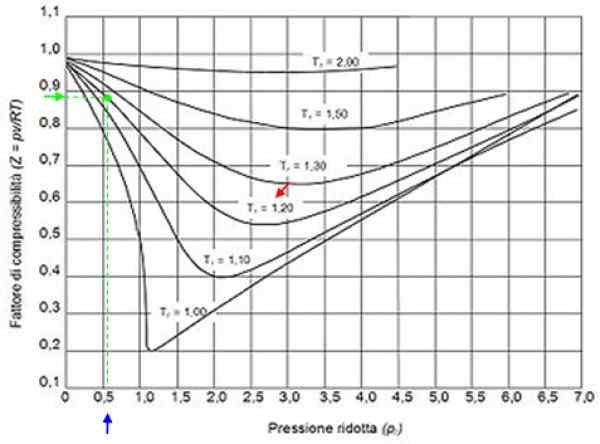 Gambar 2. Grafik grafis grafik untuk gas sesuai tekanan reduksi. Sumber: Wikimedia Commons.
Gambar 2. Grafik grafis grafik untuk gas sesuai tekanan reduksi. Sumber: Wikimedia Commons. Gas ideal
Gas ideal memiliki z = 1, seperti yang dijelaskan di awal.
Udara
Untuk udara z sekitar 1 dalam kisaran suhu dan tekanan yang luas (lihat Gambar 1), di mana model gas yang ideal memberikan hasil yang sangat baik.
Hidrogen
Z> 1 untuk semua tekanan.
Air
Untuk menemukan z air, nilai -nilai titik kritis diperlukan. Titik kritis air adalah: PC = 22.09 MPa dan tC= 374.14 ° C (647.3 k). Sekali lagi perlu untuk memperhitungkan bahwa faktor kompresibilitas z tergantung pada suhu dan tekanan.
Misalnya, misalkan Anda ingin menemukan z dari air pada 500 ºC dan 12 MPa. Maka yang pertama adalah menghitung suhu yang dikurangi, di mana derajat Celcius harus diteruskan ke Kelvin: 50 ºC = 773 K:
TR = 773/647.3 = 1.2
PR = 12/22.09 = 0.54
Dengan nilai -nilai ini kami menemukan dalam grafik gambar kurva yang sesuai dengan tR = 1.2, ditunjukkan dengan panah merah. Lalu kita melihat pada sumbu horizontal nilai pR lebih dekat ke 0.54, ditandai dengan warna biru. Sekarang kita menggambar vertikal sampai mencegat kurva TR = 1.2 Dan akhirnya diproyeksikan dari titik itu ke sumbu vertikal, di mana kita membaca nilai perkiraan z = 0.89.
Latihan terpecahkan
Latihan 1
Ada sampel gas pada suhu 350 K dan tekanan 12 atmosfer, dengan volume molar 12 % lebih tinggi dari yang diprediksi oleh hukum gas ideal. Menghitung:
A) Z Faktor Kompresi.
b) Volume gas molar.
Dapat melayani Anda: reaksi ireversibel: karakteristik dan contohc) Menurut hasil di atas, menunjukkan mana kekuatan dominan dalam sampel gas ini.
Data: r = 0,082 l.atm/mol.K
Solusi untuk
Mengetahui bahwa v nyata 12 % lebih tinggi dari Videal :
Vnyata = 1.12videal
Z = v nyata / Videal = 1.12
Solusi b
P . Vnyata = Z. R. T → vnyata = (1.12 x 0.082 x 350/12) l /mol = 2.14 l/mol.
Solusi c
Gaya tolakan adalah pasukan yang mendominasi, karena volume sampel meningkat.
Latihan 2
Ada 10 mol etana yang terkurung dalam volume 4.86 L A 27 ºC. Temukan tekanan yang diberikan oleh etana dari:
a) Model Gas Ideal
b) persamaan van der waals
c) Temukan faktor kompresi dari hasil sebelumnya.
Data untuk Ethane
Koefisien van der Waals:
A = 5.489 dm6. ATM . mol-2 dan b = 0.06380 dm3. mol-1.
Tekanan Kritis: 49 ATM. Suhu Kritis: 305 K
Solusi untuk
Suhu diteruskan ke Kelvin: 27 º C = 27 +273 K = 300 K, Juga ingat bahwa 1 liter = 1 l = 1 dm3.
Kemudian data yang disediakan dalam persamaan gas ideal diganti:
P.V = n.R.T → P = (10 x 0,082 x 300/4.86 l) atm = 50.6 atm
Solusi b
Persamaan Status Van der Waals adalah:
Dimana a dan b adalah koefisien yang diberikan oleh pernyataan itu. Saat membersihkan P:
Solusi c
Kami menghitung tekanan dan suhu yang dikurangi:
PR = 35.2/49 = 0.72
TR = 300 /305 = 0.98 ≈ 1
Dengan nilai -nilai ini, nilai z dalam grafik Gambar 2 dicari, menemukan bahwa z sekitar 0.7.
Referensi
- Atkins, hlm. 1999. Kimia Fisik. Edisi Omega.
- Cengel, dan. 2012. Termodinamika. 7ma Edisi. Bukit McGraw.
- Engel, t. 2007. Pengantar fisikokimia: termodinamika. Pearson.
- Levine, i. 2014. Prinsip-prinsip fisika-kimia. 6. Edisi. Bukit McGraw.
- Wikipedia. Faktor kompresibilitas. Diperoleh dari: di.Wikipedia.org.

