Karakteristik fenilalanin, fungsi, biosintesis, makanan
- 4244
- 759
- Dewey Runolfsdottir
Itu Fenilalanin (Phe, f) adalah salah satu dari 9 asam amino esensial, yaitu, tidak disintesis secara endogen oleh tubuh manusia. Dalam rantai sampingnya, asam amino ini memiliki senyawa aromatik non -pololar yang menjadi ciri khasnya.
Asam fenilalanin, atau β-phenyl-α-amino propionic pertama kali diidentifikasi pada tahun 1879 oleh para ilmuwan j. H. Schulze dan m. Barbieri dari tanaman dari keluarga Fabaceae yang dikenal sebagai Lupinus luteus atau "Yellow Altramuz".
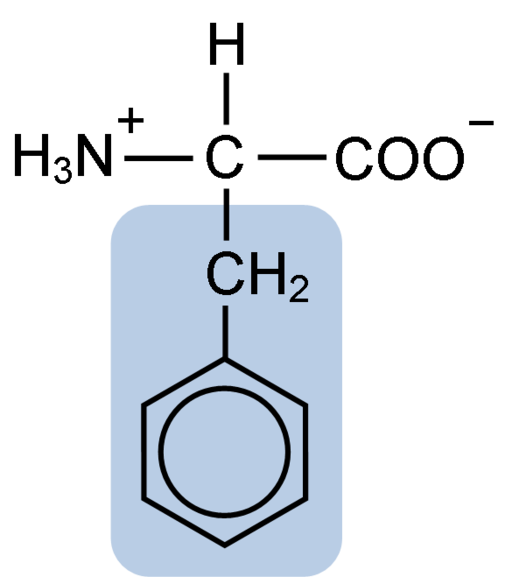
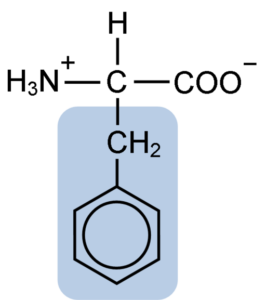 Struktur Kimia Fenilalanin Asam Amino (Sumber: Clavecin [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] via Wikimedia Commons)
Struktur Kimia Fenilalanin Asam Amino (Sumber: Clavecin [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] via Wikimedia Commons) Dipéptide L-Fenylalanin-L-Aspartil dikenal sebagai aspartam atau "Nutrasweet", yang merupakan pemanis yang diproduksi secara sintetis dan banyak digunakan di restoran dan kedai kopi, biasanya untuk memaniskan minuman seperti kopi, teh, limun dan minuman lainnya minuman lainnya,.
Dalam buah-buahan dengan karakteristik yang dipanaskan, konversi L-phenylalanine dalam ester fenolik seperti eugenol dan turunan metiliknya adalah apa yang memunculkan aroma bunga manis atau mirip dengan madu khas pisang dan buah-buahan pisang saat matur.
Tergantung pada bentuknya, fenilalanin dapat memiliki rasa yang berbeda. Misalnya, bentuk L-fenylalanine memiliki aroma dan rasa manis, sedangkan D-fenylalanine sedikit pahit dan biasanya TOOD.
Karena memiliki karakter hidrofobik yang kuat, fenilalanin adalah salah satu konstituen utama dari banyak resin di alam, seperti polystyrene. Resin ini, saat bersentuhan dengan molekul air, membentuk struktur pelindung atau cakupan yang dikenal sebagai "clatrato".
Gen yang mengkode rute biosintesis fenilalanin digunakan oleh ahli botani sebagai jam tangan evolusi, karena telah ditemukan bahwa ini terkait dengan diversifikasi morfologis tanaman terestrial.
[TOC]
Karakteristik dan struktur
Fenilalanin berbagi dengan semua asam amino gugus karboksil (-COH), gugus amino (-NH2), dan atom hidrogen (-H) yang melekat pada atom karbon sentral yang dikenal sebagai karbon α. Selain itu, tentu saja, ia memiliki rantai samping atau kelompok R karakteristik.
Fenilalanin adalah salah satu dari tiga asam amino yang memiliki cincin aromatik atau benzena sebagai substituen dalam rantai lateral. Senyawa ini tidak polar dan, oleh karena itu, sangat hidrofobik.
Asam amino yang dimaksud terutama hidrofobik, karena, tidak seperti tirosin dan triptofan (dua asam amino lainnya dengan cincin aromatik) tidak memiliki gugus amino atau hidroksil yang disatukan dengan cincin benzenanya.
Kelompok fenilalanin aromatik, benzoik atau sandylalanin memiliki struktur benzena yang khas: cincin siklik disusun oleh 6 atom karbon yang memiliki resonansi di antara mereka karena adanya tiga ikatan rangkap dan tiga ikatan sederhana di dalamnya.
Tidak seperti tirosin dan triptofan, yang dapat memperoleh beban positif dan negatif, masing -masing, fenilalanin mempertahankan beban netral, karena cincin benzena tidak terionisasi dan beban kelompok karboksil dan amino saling menetralkan satu sama lain.
Klasifikasi
Asam amino diklasifikasikan ke dalam kelompok yang berbeda sesuai dengan karakteristik yang dimiliki rantai samping atau kelompok R mereka, karena mereka dapat bervariasi dalam ukuran, struktur, kelompok fungsional dan bahkan dalam muatan listrik.
Seperti disebutkan, fenilalanin diklasifikasikan dalam kelompok asam amino aromatik, bersama dengan tirosin dan triptofan. Semua senyawa ini memiliki cincin aromatik dalam strukturnya, namun, tirosin dan triptofan memiliki gugus terionisasi dalam substituen kelompok R mereka.
Dapat melayani Anda: Speciation Allopatric: Konsep, Proses, dan ContohKarakteristik penyerapan cahaya protein pada panjang gelombang 280 nm disebabkan oleh adanya asam amino yang diklasifikasikan dalam gugus fenilalanin, karena mereka dengan mudah menyerap cahaya ultraviolet melalui cincin aromatiknya.
Namun, telah ditunjukkan bahwa fenilalanin menyerap dalam proporsi yang jauh lebih sedikit daripada tirosin dan triptofan, jadi dalam analisis beberapa protein absorbansi dapat diprediksi.
Stereokimia
Semua asam amino memiliki karbon quiral sentral, yang memiliki empat atom atau kelompok bersatu dan, seperti yang telah dikatakan, atom ini diidentifikasi sebagai karbon α. Berdasarkan karbon ini, setidaknya dua stereoisomer dari masing -masing asam amino dapat ditemukan.
Stereoisomer adalah molekul dengan gambar specular, yang memiliki formula molekul yang sama, tetapi itu tidak tumpang tindih satu sama lain seperti, misalnya, tangan dan kaki. Senyawa yang secara eksperimental memutar bidang cahaya terpolarisasi kanan dilambangkan dengan huruf D, dan yang melakukannya di sebelah kiri, dengan huruf L.
Penting untuk berkomentar bahwa perbedaan antara bentuk D-phenylalanine dan L-fenylalanine adalah kunci untuk memahami metabolisme asam amino ini dalam tubuh vertebrata.
Bentuk L-phenylalanine dimetabolisme dan dieksploitasi untuk konstruksi protein sel, sedangkan D-fenylalanine telah ditemukan dalam aliran darah sebagai agen pelindung terhadap spesies oksigen reaktif (ROS).
Fungsi
Di tahun 90 -an diperkirakan bahwa fenilalanin hanya pada beberapa spesies tanaman. Namun, hari ini diketahui bahwa ia hadir di hampir semua domain hidrofobik protein, pada kenyataannya, fenilalanin adalah komponen utama dari spesies kimia aromatik protein.
Pada tanaman, fenilalanin adalah komponen penting dari semua protein; Selain itu, ini adalah salah satu prekursor metabolit sekunder seperti fenilpropanoid (yang merupakan bagian dari pigmen) dari molekul defensif, flavonoid, biopolimer seperti lignin dan suberin, antara lain.
Fenilalanin adalah struktur dasar untuk membentuk banyak molekul yang mempertahankan homeostasis neuron, di antaranya adalah peptida seperti vasopresin, melanotropin dan ensefalin. Selain itu, asam amino ini terlibat langsung dalam sintesis hormon adrenokortopik (ACTH).
Seperti banyak asam amino protein, fenilalanin adalah bagian dari kelompok asam amino ketogenik dan glukogenik, karena memberikan kerangka karbon perantara dari siklus Krebs, yang diperlukan untuk metabolisme sel dan energi tubuh.
Ketika berlebihan, fenilalanin diubah menjadi tirosin dan kemudian menjadi fumarat, perantara dari siklus Krebs.
Biosintesis
Fenilalanin adalah salah satu dari sedikit asam amino yang tidak dapat disintesis oleh sebagian besar organisme vertebrata. Saat ini, hanya rute biosintesis yang dikenal karena asam amino ini dalam organisme prokariotik, dalam ragi, pada tanaman dan pada beberapa spesies jamur.
Gen yang bertanggung jawab untuk rute sintesis sangat dipertahankan antara tanaman dan mikroorganisme, oleh karena itu, biosintesis memiliki langkah yang sama di hampir semua spesies. Bahkan beberapa enzim pada rute hadir pada beberapa hewan, namun, ini tidak dapat mensintesisnya.
Biosintesis fenilalanin pada tanaman
Pada spesies tanaman, fenilalanin disintesis melalui rute metabolisme internal di kloroplas yang dikenal sebagai "rute predetenate". Rute ini secara metabolik terkait dengan "Rute Shikimato", melalui L-Arogenato, salah satu metabolit yang diproduksi selama yang terakhir.
Dapat melayani Anda: topoisomerase: apa itu, karakteristik, fungsi, jenisEnzim AREWOOD inhidrataa mengkatalisasi reaksi tiga langkah, di mana ia mengubah cincin aromatik arogenat menjadi cincin benzenik fenilalanin yang khas.
Enzim ini mengkatalisasi transaminasi, dehidrasi dan dekarn.
Predeneate di sebelah akumulasi fenilpiruvat di dalam (cahaya) kloroplas, dapat dikonversi menjadi fenilalanin dengan reaksi yang dikatalisis oleh enzim aminotransferase propenato, yang mentransfer kelompok amino dan pemakaman fenilpirivat sehingga dikenali oleh arogenate DEHGAGEATECED SO yang diakui oleh arogenate DEHGYDREDDRUVATE ke sintesis fenilalanin.
Di beberapa spesies Pseudomonas Rute alternatif telah dijelaskan oleh Profenato, yang menggunakan enzim yang berbeda tetapi yang substratnya untuk sintesis fenilalanin juga merupakan predetenat dan arogenat.
Degradasi
Fenilalanin dapat dimetabolisme dalam berbagai cara dari makanan. Namun, jumlah penelitian terbesar fokus pada tujuan mereka pada sel jaringan saraf pusat dan jaringan ginjal.
Hati adalah organ utama untuk degradasi atau katabolisme fenilalanin. Dalam hepatosit ada enzim yang dikenal sebagai hidroksilase fenilalanin, yang mampu mengubah fenilalanin menjadi tirosin atau dalam senyawa L-3,4-dihydroxyphenylalanine (L-DOPA).
Senyawa L-dopa adalah prekursor norepinefrin, epinefrin dan hormon dan peptida lainnya dengan aktivitas dalam sistem saraf.
Fenilalanin dapat dioksidasi dalam sel-sel otak dengan menggunakan enzim hidroksilase tirosin, yang bertanggung jawab untuk mengkatalisasi konversi fenilalanin menjadi dopakrom dengan adanya asam L-askorbat.
Sebelumnya diperkirakan bahwa hidroksilase tirosin hidroksilase hanya tirosin, namun, ditemukan bahwa fenilalanin dan tirosin hidroksil ini dalam proporsi yang sama dan bahwa hidroksilasi fenilalanin menghambat hidroksilasi tirosin.
Saat ini diketahui bahwa proporsi tinggi tirosin menghambat aktivitas enzimatik hidroksilase tirosin, tetapi hal yang sama tidak berlaku untuk fenilalanin.
Makanan yang kaya akan fenilalanin
Semua makanan kaya protein memiliki kandungan fenilalanin antara 400 dan 700 mg untuk porsi makanan yang tertelan. Makanan seperti minyak cod, tuna segar, lobster, tiram dan bivalva lainnya, mengandung lebih dari 1.000 mg per porsi makanan yang tertelan.
Daging sapi dan babi juga memiliki kadar fenilalanin yang tinggi. Namun, mereka tidak setinggi konsentrasi yang ada pada hewan laut. Misalnya, produk daging, daging sapi, hati, ayam, dan susu memiliki antara 700 dan 900 mg fenilalanin dengan ransum makanan.
Kacang -kacang seperti kacang dan kacang -kacangan dari berbagai jenis adalah makanan lain yang memiliki jumlah fenilalanin yang baik. Biji -bijian seperti kedelai, buncis dan legum lainnya dapat menyediakan antara 500 dan 700 mg fenilalanin dengan porsi.
Sebagai sumber alternatif, fenilalanin dapat dimetabolisme dari aspartam.
Manfaat Asupan Anda
Fenilalanin ditemukan di semua makanan kaya protein yang kami konsumsi. Konsumsi harian minimum untuk orang dewasa dan ukuran rata -rata adalah sekitar 1000 mg, diperlukan untuk sintesis protein, hormon seperti dopamin, dari neurotransmiter yang berbeda, dll.
Itu bisa melayani Anda: apa keragaman alam bumi?Konsumsi asam amino berlebih ini diresepkan untuk orang yang memiliki gangguan depresi, nyeri sendi dan penyakit kulit, karena konsumsinya meningkatkan sintesis protein dan menularkan biomolekul seperti epinefrin, norepinefrin dan dopamin.
Beberapa penelitian menunjukkan bahwa fenilalanin yang dikonsumsi secara berlebihan tidak menghasilkan peningkatan yang signifikan pada gangguan ini, tetapi konversi mereka menjadi tirosin, yang juga digunakan untuk sintesis molekul pensinyalan, dapat menjelaskan efek positif pada pensinyalan sel dalam sistem saraf di dalam sistem saraf.
Obat yang diformulasikan terhadap sembelit memiliki inti yang disusun oleh fenilalanin, tirosin dan triptofan. Umumnya obat-obatan ini mengandung campuran dari tiga asam amino ini dalam bentuknya-.
Gangguan Kekurangan
Tingkat fenilalanin darah penting untuk mempertahankan fungsi otak yang tepat, karena fenilalanin, tirosin dan triptofan adalah substrat untuk perakitan neurotransmiter yang berbeda.
Beberapa gangguan berhubungan, lebih, dengan defisit dalam metabolisme asam amino ini, yang menghasilkan kelebihannya, bukan kekurangan.
Phenylcetonuria, penyakit turun temurun yang tidak biasa pada wanita, mempengaruhi hidroksilasi hepatik fenilalanin dan membuat kadar plasma asam amino itu berlebihan, sehingga apoptosis neuron diinduksi dan mempengaruhi perkembangan normal otak otak dan normal.
Jika seorang wanita dengan phenylcetonuria menjadi hamil, janin dapat menyajikan apa yang dikenal sebagai "hiperfenilalaninemia ibu janin" janin ".
Ini karena janin memiliki konsentrasi fenilalanin yang tinggi dalam darah (hampir dua kali lipat standar), yang aslinya terkait dengan tidak adanya hidroksilase hepatik fetus, yang tidak berkembang sampai 26 minggu kehamilan kehamilan kehamilan.
Sindrom janin oleh hiperfenilalaninemia ibu, menghasilkan mikrosefali janin, aborsi berulang, penyakit jantung dan bahkan malformasi ginjal.
Referensi
- Biondi, r., Brancorsini, s., Poli, g., Egidi, m. G., Capodicasa, e., Bottiglieri, l.,… & Micu, r. (2018). Deteksi dan pemulungan radikal hidroksil melalui hidroksilasi D-phenylalanine dalam cairan manusia. Talanta, 181, 172-181
- Cho, m. H., Korea, o. R., Yang, h., Bedgar, d. L., Laskar, d. D., Anterola, a. M.,… & Kang, c. (2007). Biosintesis fenilalanin di Arabidopsis Thalia Identifikasi dan Karakter Dehidrata Argenate. Jurnal Kimia Biologi, 282 (42), 30827-30835.
- Fernstrom, J. D., & Fernstrom, m. H. (2007). Tyrosine, fenilalanin, dan sintesis dan fungsi cathocholamine di otak. The Journal of Nutrition, 137 (6), 1539S-1547S.
- Hou, J., Vázquez-González, m., Fadeev, m., Liu, x., Lavi, r., & Willner, i. (2018). Oksidasi L-tyrosine dan L-phenylalanine yang tersumbat menjadi dopachrome oleh nanozim oleh nanozim. Nano Letters, 18 (6), 4015-4022.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Prinsip -prinsip biokimia lehninger. Macmillan.
- Perkins, r., & Vaida, v. (2017). Fenilalanin meningkatkan permeabilitas membran. Jurnal American Chemical Society, 139 (41), 14388-14391.
- Plimmer, r. H. KE. (1912). Konstitusi Kimia Protein (Vol. 1). Longmans, hijau.
- Tensley, g. (2018). Garis kesehatan. Diperoleh 5 September 2018, dari www.Garis kesehatan.com/nutrisi/fenilalanin
- Tohge, t., Watanabe, m., Hoefgen, r., & Fernie, untuk. R. (2013). Biosintesis Shikimate dan Phenylalanine di Green Lineage. Perbatasan dalam Ilmu Tanaman, 4, 62.
- « Karakteristik isoleucine, fungsi, biosintesis, makanan
- Karakteristik Front Nasional, Tujuan, Presiden »

