Riwayat fluoror, sifat, struktur, memperoleh, risiko, penggunaan
- 3789
- 985
- Irvin Reichel
Dia fluor Itu adalah elemen kimia yang diwakili dengan simbol F dan kepala kelompok 17, yang menjadi hal halogen. Ini dibedakan di atas elemen -elemen lain dari tabel periodik, untuk menjadi yang paling reaktif dan elektronegatif; bereaksi hampir dengan semua atom, sehingga membentuk garam dan senyawa organisasi yang tak terhitung jumlahnya.
Dalam kondisi normal itu adalah gas kuning pucat, yang dapat dikacaukan dengan hijau kekuningan. Dalam keadaan cair, ditunjukkan pada gambar yang lebih rendah, warna kuningnya semakin meningkat, yang menghilang sepenuhnya ketika koket di titik bekunya.
 Fluor cair dalam tabung reaksi. Sumber: fulvio314 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Fluor cair dalam tabung reaksi. Sumber: fulvio314 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Ini adalah reaktivitas seperti itu, terlepas dari volatile gasnya, yang tetap terperangkap di kerak bumi; Terutama dalam bentuk mineral fluorit, yang dikenal dengan kristal violetnya. Demikian juga, reaktivitasnya menjadikannya zat yang berpotensi berbahaya; Bereaksi dengan penuh semangat dengan segala sesuatu yang menyentuh dan membakar api.
Namun, banyak produk yang diturunkan bisa tidak berbahaya dan bahkan bermanfaat, tergantung pada aplikasi mereka. Misalnya, penggunaan fluoride yang paling populer, ditambahkan dalam bentuk ionik atau mineral (seperti garam fluoride), terdiri dari persiapan pasta gigi dengan fluoride, yang membantu melindungi enamel gigi gigi.
Fluor menyajikan kekhasan bahwa jumlah tinggi atau keadaan oksidasi dapat menstabilkan untuk banyak elemen lainnya. Semakin besar jumlah atom fluor, semakin reaktif senyawa tersebut (kecuali jika itu adalah polimer). Demikian juga, efeknya dengan matriks molekuler akan meningkat; Untuk lebih baik atau lebih buruk.
[TOC]
Sejarah
Penggunaan fluorit
Pada 1530, ahli mineral Jerman Georgius Agricola menemukan bahwa mineral fluorspar dapat digunakan dalam pemurnian logam. Fluorspar adalah nama lain untuk fluorit, mineral fluor yang terdiri dari kalsium fluoride (CAF2).
Elemen fluor tidak ditemukan pada saat itu dan "fluoir" dalam fluorit berasal dari kata Latin "fluere" yang berarti "aliran"; Karena, inilah yang dilakukan fluorspar atau fluorit dengan logam: itu membantu mereka meninggalkan sampel.
Persiapan asam fluorhorat
Pada 1764, Andreas Sigismud Margraff berhasil. Kaca pengembalian dilebur oleh aksi asam, sehingga gelas digantikan oleh logam.
Ini juga dikaitkan dengan Carl Scheele pada 1771, persiapan asam dengan metode yang sama diikuti oleh Margraff. Pada tahun 1809, ilmuwan Prancis Andre-Marie Ampere mengusulkan bahwa asam fluorik atau fluorhorat adalah senyawa yang dibentuk oleh hidrogen dan elemen baru yang mirip dengan klorin.
Para ilmuwan mencoba mengisolasi fluorin melalui penggunaan asam fluororis untuk waktu yang lama; Tapi bahayanya membuat kemajuan dalam hal ini.
Humphry Davy, Joseph Louis Gay-Lussac dan Jacques Thénard memiliki rasa sakit yang kuat saat menghirup hidrogen fluorida (asam fluorida tanpa air dan dalam bentuk gas))). Dalam keadaan yang sama, para ilmuwan Paulin Louyet dan Jerome Nickles meninggal karena keracunan.
Edmond Fréme, peneliti Prancis, mencoba membuat asam fluorhoride kering untuk menghindari toksisitas hidrogen fluorida dengan pengasaman kalium bifluoride (KHF2), Tetapi selama elektrolisis tidak ada konduksi arus listrik.
Isolasi
Pada tahun 1860, ahli kimia Inggris, George Gore mencoba. Namun, ada ledakan dengan merebut kembali hidrogen dengan fluoride. Gore mengaitkan ledakan dengan kebocoran oksigen.
Pada tahun 1886, ahli kimia Prancis Henri Moisson berhasil mengisolasi fluoride untuk pertama kalinya. Sebelumnya, karya Moisson terganggu empat kali karena keracunan serius dengan hidrogen fluoride, sambil mencoba mengisolasi elemen.
Moisson adalah seorang mahasiswa frony dan didasarkan pada eksperimennya untuk mengisolasi fluoride. Moisson digunakan dalam elektrolisis campuran kalium fluorida dan asam fluorhororat. Solusi yang dihasilkan LED Listrik dan gas fluor yang terakumulasi dalam anoda; yaitu, dalam elektroda yang dimuat secara positif.
Moisson menggunakan peralatan yang tahan korosi, di mana elektroda terbuat dari paduan platinum dan iridium. Dalam elektrolisis ia menggunakan wadah platinum dan mendinginkan larutan elektrolitik pada suhu -23 ºF (-31 ºC).
Akhirnya, pada tanggal 26 Juni 1886, Henri Moisson berhasil mengisolasi Fluoride, sebuah karya yang memungkinkannya untuk memenangkan Hadiah Nobel pada tahun 1906.
Minat pada fluoride
Untuk sementara minat dalam penyelidikan dengan fluoride hilang. Namun, pengembangan proyek Manhattan untuk produksi bom atom.
Perusahaan Amerika DuPont berkembang, antara tahun 1930 dan 1940, produk berfluorinasi seperti klorofluorokarbonat (Freon-12), digunakan sebagai refrigeran; dan plastik plastik Polythetrafluoroethylene, paling dikenal dengan nama Teflon. Ini menghasilkan peningkatan produksi dan konsumsi fluorin.
Pada tahun 1986, pada sebuah konferensi selama satu abad isolasi fluor, ahli kimia Amerika Karl atau. Christe menyajikan metode kimia untuk persiapan fluoride dengan reaksi antara k2MNF6 dan SBF5.
Dapat melayani Anda: alkohol polivinilSifat fisik dan kimia
Penampilan
Fluor adalah gas kuning pucat. Dalam keadaan cair berwarna kuning cerah. Sementara itu, padatan bisa buram (alpha) atau transparan (beta).
Nomor Atom (Z)
9.
Berat atom
18.998 u.
Titik lebur
-219.67 ºC.
Titik didih
-188.11 ºC.
Kepadatan
Pada suhu kamar: 1.696 g/l.
Pada titik leleh (cair): 1.505 g/ml.
Panas penguapan
6,51 kJ/mol.
Kapasitas kalori molar
31 J/(mol · k).
Tekanan uap
Pada suhu 58 K memiliki tekanan uap 986,92 atm.
Konduktivitas termal
0,0277 w/(m · k)
Urutan magnetik
Diamagnetik
Bau
Bau karakteristik pedas dan menembus, terdeteksi bahkan pada 20 ppb.
Angka oksidasi
-1, yang sesuai dengan anion fluoride, f-.
Energi ionisasi
-Pertama: 1.681 kJ/mol
-Kedua: 3.374 kJ/mol
-Ketiga: 6.147 kJ/mol
Elektronegativitas
3.98 pada skala Pauling.
Ini adalah elemen kimia dengan elektronegativitas terbesar; yaitu, ia memiliki afinitas tinggi untuk elektron atom yang terkait dengan yang dihubungkan. Karena itu, atom fluor menghasilkan momen dipol besar di daerah spesifik molekul.
Elektronegativitasnya juga memiliki efek lain: atom yang terkait dengannya kehilangan begitu banyak kepadatan elektronik sehingga mereka mulai memperoleh beban positif; Ini adalah angka oksidasi yang positif. Atom yang lebih fluor dalam suatu senyawa, atom pusat akan memiliki jumlah oksidasi yang lebih positif.
Misalnya, di OF2 Oksigen memiliki jumlah oksidasi +2 (atau2+F2-); Di UF6, Uranium memiliki jumlah oksidasi +6 (u6+F6-); Hal yang sama berlaku untuk belerang di SF6 (S6+F6-); Dan akhirnya AGF2, di mana perak bahkan memiliki jumlah oksidasi +2, tidak biasa di dalamnya.
Oleh karena itu, elemen berhasil berpartisipasi dengan bilangan oksidasi paling positif ketika mereka membentuk senyawa dengan fluoride.
Agen pengoksidasi
Fluor adalah elemen pengoksidasi yang paling kuat, sehingga tidak ada zat yang mampu mengoksidasi itu; Dan karena alasan ini, dia tidak bebas di alam.
Reaktivitas
Fluor mampu bergabung dengan semua elemen lainnya, kecuali dengan helium, neon dan argon. Itu juga tidak menyerang baja manis atau tembaga pada suhu normal. Bereaksi keras dengan bahan organik, seperti karet, kayu dan kain.
Fluoride dapat bereaksi dengan xenon gas mulia untuk membentuk oksidan difluoruro yang kuat dari xenon, xef2. Ini juga bereaksi dengan hidrogen untuk membentuk halida, hidrogen fluorida, HF. Pada gilirannya, hidrogen fluorida dilarutkan dalam air untuk menghasilkan asam fluorhorority yang terkenal (makan gelas).
Keasaman asam hidrace, diklasifikasikan dalam urutan yang meningkat adalah:
HF < HCl < HBr < HI
Asam nitrat bereaksi dengan fluoride untuk membentuk fluorin nitrat, FNO3. Sementara itu, asam klorida bereaksi dengan kuat dengan fluoride untuk membentuk HF, dari2 dan clf3.
Struktur dan konfigurasi elektronik

Molekul diatomik
 Molekul fluoride diwakili dengan model pengisian ruang. Sumber: Gabriel Bolívar.
Molekul fluoride diwakili dengan model pengisian ruang. Sumber: Gabriel Bolívar. Atom fluor dalam keadaan basal memiliki tujuh elektron Valencia, yang ada di orbital 2S dan 2P sesuai dengan konfigurasi elektronik:
[Dia] 2s2 2 p5
The Valencia Link Theory (TEV) menetapkan bahwa dua atom fluor, F, secara kovalen terkait dengan dapat menyelesaikan oktet mereka di Valencia masing -masing.
Ini terjadi dengan cepat karena hampir tidak memiliki elektron untuk menjadi isolektronik ke gas neon yang mulia; Dan atom -atomnya sangat kecil, dengan beban nuklir yang sangat kuat yang mudah menuntut elektron lingkungan.
Molekul f2 (Gambar superior), memiliki tautan kovalen sederhana, f-f. Meskipun stabilitasnya dibandingkan dengan atom F bebas, ini adalah molekul yang sangat reaktif; Homonuklear, apolar, dan bersemangat untuk elektron. Itulah mengapa fluoride, seperti f2, Itu adalah spesies yang sangat beracun dan berbahaya.
Karena f2 Itu apolar, interaksinya tergantung pada massa molekulnya dan kekuatan dispersi London. Pada titik tertentu, awan elektronik di sekitar kedua atom F harus berubah bentuk dan berasal dari dipol instan yang menginduksi yang lain dalam molekul tetangga; sehingga mereka perlahan dan lemah.
Cair dan padat
Molekul f2 Itu sangat kecil dan menyebar di ruang angkasa dengan kecepatan relatif. Dalam fase gasnya, ia menunjukkan warna kuning pucat (yang dapat dikacaukan dengan hijau limau). Saat suhu turun ke -188 ºC, gaya dispersi menjadi lebih efektif dan membuat molekul f2 cukup kohesi untuk mendefinisikan cairan.
Fluor cair (gambar pertama), terlihat lebih kuning dari gas masing -masing. Di dalamnya, molekul f2 Mereka lebih dekat dan berinteraksi dengan cahaya dalam tingkat yang lebih besar. Menariknya, begitu kaca kubik yang terdistorsi terbentuk dari fluor hingga -220 ºC, warnanya memudar dan tetap menjadi padatan transparan.
Dapat melayani Anda: alkana bercabangSekarang molekul M2 Mereka begitu dekat (tetapi tanpa rotasi molekul mereka berhenti), tampaknya elektron mereka mendapatkan stabilitas dan, oleh karena itu, lompatan elektronik mereka terlalu besar untuk cahaya bahkan berinteraksi dengan kaca.
Fase kristal
Kristal kubik ini sesuai dengan fase β (ini bukan alotropik karena tetap sama f2). Ketika suhu turun lebih banyak lagi, hingga -228 ºC, fluor padat mengalami transisi fase; Kaca kubik diubah menjadi monoklinik, fase α:
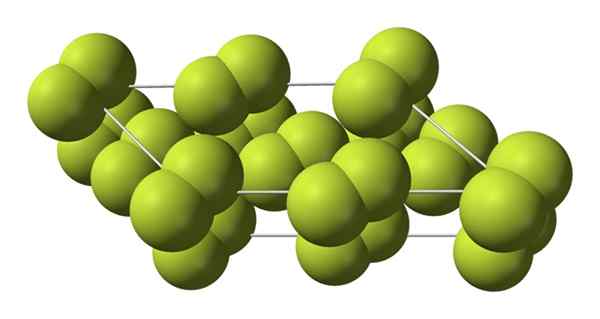
 Struktur kristal fase alfa fluorin. Sumber: Benjah-BMM27 [Domain Publik].
Struktur kristal fase alfa fluorin. Sumber: Benjah-BMM27 [Domain Publik]. Tidak seperti β-f2, Α-f2 itu buram dan sulit. Mungkin itu karena molekul M2 Mereka tidak lagi memiliki kebebasan untuk berputar di posisi tetap mereka dalam kristal monoklinik; di mana mereka berinteraksi ke tingkat yang lebih besar dengan cahaya, tetapi tanpa menggairahkan elektron mereka (yang secara dangkal akan menjelaskan opacity mereka).
Struktur kristal α-F2 Sulit untuk dipelajari melalui metode difraksi x -ray konvensional. Ini karena transisi dari fase β ke α sangat eksotermik; Jadi kristal yang secara praktis dieksploitasi, sambil sedikit berinteraksi dengan radiasi.
Mereka menghabiskan sekitar lima puluh tahun sebelum ilmuwan Jerman (Florian Kraus dan kolaborator), sepenuhnya menguraikan struktur α-F2 dengan presisi yang lebih besar berkat teknik difraksi neutron.
Dimana itu dan dapatkan
Fluor menempati tanggal 24 elemen paling umum di alam semesta. Namun, di Bumi dalam massa 13vo elemen, dengan konsentrasi 950 ppm di kerak bumi, dan konsentrasi 1,3 ppm di air laut.
Tanah memiliki konsentrasi fluor antara 150 dan 400 ppm, dan pada beberapa tanah konsentrasi dapat mencapai 1.000 ppm. Di udara atmosfer itu hadir dalam konsentrasi 0,6 ppb; Tetapi telah terdaftar di beberapa kota hingga 50 ppb.
Fluor diperoleh terutama dari tiga mineral: fluorit atau fluorospar (kopi2), Fluoroapatita [CA5(PO4)3F] dan kreol (na3Alf6).
Pemrosesan fluorit
Setelah mengumpulkan batu dengan mineral fluorit, ini tunduk pada penghancuran primer dan sekunder. Dengan penghancuran sekunder mendapatkan fragmen batu yang sangat kecil.
Kemudian, fragmen batu dibawa ke pabrik bola untuk pengurangan debu. Air dan reagen ditambahkan untuk membentuk pasta, yang ditempatkan di tangki flotasi. Itu disuntikkan dengan tekanan untuk membentuk gelembung, dan dengan demikian fluorit berakhir di permukaan air.
Silikat dan karbonat adalah sedimen saat fluorit dikumpulkan dan menyebabkan oven pengeringan.
Setelah fluorit diperoleh, ia bereaksi dengan asam sulfat untuk menghasilkan hidrogen fluorida:
Kaf2 + H2Sw4 => 2 hf +case4
Elektrolisis Hidrogen Fluoride
Dalam produksi fluoride, beberapa modifikasi diikuti, dengan metode yang digunakan oleh Moisson pada tahun 1886.
Elektrolisis dari campuran kalium cair fluoride dan asam fluohidrat dibuat, dengan jari -jari molar 1: 2.0 hingga 1: 2.2. Suhu garam cair adalah 70 - 130 ºC.
Katoda terdiri dari monet atau paduan baja, dan anodanya memesan kembali batubara. Proses produksi fluor selama elektrolisis dapat ditrempa sebagai berikut:
2hf => h2 + F2
Air digunakan untuk mendinginkan ruang elektrolisis, tetapi suhunya harus di atas titik leleh elektrolit untuk menghindari pemadatan. Hidrogen yang diproduksi dalam elektrolisis dikumpulkan dalam katoda, sedangkan fluoride dalam anoda.
Isotop
Fluoride memiliki 18 isotop, menjadi 19F Satu -satunya isotop stabil dengan kelimpahan 100%. Dia 18F memiliki setengah kehidupan 109,77 menit dan merupakan isotop radioaktif fluor dengan setengah -kehidupan terbesar. Dia 18F Ini digunakan sebagai sumber positron.
Kertas Biologis
Tidak ada aktivitas metabolisme fluor pada mamalia atau tanaman atas yang diketahui. Namun, beberapa tanaman laut dan spons mensintesis monofluroasetat, senyawa beracun, yang digunakan sebagai perlindungan untuk menghindari kehancuran.
Risiko
Konsumsi fluor yang berlebihan telah dikaitkan dengan fluorosis tulang pada orang dewasa dan fluorosis gigi pada anak -anak, serta dengan perubahan fungsi ginjal. Untuk alasan ini, Layanan Kesehatan Masyarakat Amerika Serikat (PHS) menyarankan bahwa konsentrasi fluoride dalam air minum tidak boleh lebih besar dari 0,7 mg/L/L.
Sementara itu, Badan Perlindungan Enviromental AS (EPA) menetapkan bahwa konsentrasi fluoride dalam air minum tidak boleh lebih besar dari 4mg/L, untuk menghindari fluorosis kerangka, di mana fluoride menumpuk di dalam tulang. Ini dapat menyebabkan melemah dan patah tulang.
Fluor telah terkait dengan kerusakan kelenjar paratiroid, dengan penurunan kalsium dalam struktur tulang dan konsentrasi kalsium yang tinggi dalam plasma.
Itu dapat melayani Anda: materi hidup: konsep, karakteristik dan contohDi antara perubahan yang dikaitkan dengan kelebihan fluor adalah sebagai berikut: fluorosis gigi, fluorosis kerangka dan kerusakan pada kelenjar paratiroid.
Fluorosis gigi
Fluorosis gigi disajikan dengan garis -garis kecil atau sepeda motor dalam enamel gigi. Anak -anak di bawah 6 tidak boleh menggunakan obat kumur yang mengandung fluoride.
Fluorosis kerangka
Dalam fluorosis kerangka, kerusakan nyeri dan kerusakan dapat didiagnosis, serta pada sendi. Tulang dapat mengeras dan kehilangan elastisitas, yang meningkatkan risiko patah tulang.
Aplikasi
Pasta gigi
 Beberapa garam fluoride anorganik digunakan sebagai aditif dalam formulasi pasta gigi, yang telah menunjukkan bahwa mereka membantu melindungi enamel gigi. Sumber: Pxhere.
Beberapa garam fluoride anorganik digunakan sebagai aditif dalam formulasi pasta gigi, yang telah menunjukkan bahwa mereka membantu melindungi enamel gigi. Sumber: Pxhere. Kami mulai dengan bagian penggunaan untuk fluoride dengan yang paling terkenal: untuk berfungsi sebagai komponen dari banyak pasta gigi. Ini bukan satu -satunya penggunaan di mana kontras antara molekulnya F dapat dilihat2, sangat beracun dan berbahaya, dan anion f-, yang tergantung pada lingkungannya bisa bermanfaat (meskipun terkadang tidak).
Saat kita makan makanan, terutama permen, bakteri menurunkannya dengan meningkatkan keasaman air liur kita. Kemudian, ada titik di mana pH cukup untuk menurunkan dan mendemineralisasi enamel gigi; Hydroxiapatite datang "turun".
Namun, dalam proses ini ion f- berinteraksi dengan ca2+ untuk membentuk matriks fluorapatite; lebih stabil dan tahan lama dari hidroksiapatit. Atau setidaknya, ini adalah mekanisme yang diusulkan untuk menjelaskan aksi anion fluoride pada gigi. Kemungkinan lebih kompleks dan ada hydroxyapatite-fluorapatite tergantung pada pH.
Anion ini f- Mereka tersedia dalam papas gigi dalam garam; seperti: NAF, SNF2 (The Famous Stine Fluoride) dan Napof. Namun, konsentrasi f- Itu harus rendah (kurang dari 0,2%), karena jika tidak, itu menyebabkan efek negatif pada tubuh.
Fluorisasi air
Sangat mirip dengan bagaimana dengan pasta gigi, garam fluoride telah ditambahkan ke sumber air minum untuk memerangi penampilan karies pada mereka yang meminumnya. Konsentrasi masih harus jauh lebih rendah (0,7 ppm). Namun, praktik ini biasanya tidak percaya dan kontroversi, mungkin efek karsinogenik telah dikaitkan.
Agen pengoksidasi
Gas f2 Itu berperilaku seperti agen pengoksidasi yang sangat kuat. Ini membuat banyak senyawa mengatur lebih dari ketika terpapar oksigen dan sumber panas. Itulah sebabnya telah digunakan dalam campuran bahan bakar roket, di mana mereka bahkan dapat menggantikan ozon.
Polimer
Dalam banyak kegunaan, kontribusi fluoride bukan karena f2 atau f-, tetapi langsung ke atom elektronegatif yang membentuk bagian dari senyawa organik. Oleh karena itu, pada dasarnya tautan C-F.
Tergantung pada struktur, polimer atau serat dengan ikatan C-F biasanya hidrofobik, sehingga mereka tidak basah atau menahan serangan asam fluorhorat; Atau lebih baik lagi, mereka bisa menjadi isolator listrik yang sangat baik, dan bahan yang berguna dengan benda -benda seperti pipa dan sambungan diproduksi. Teflon dan Navion adalah contoh dari polimer berfluorinasi ini.
Apoteker
Reaktivitas fluoride disebut penggunaannya untuk sintesis beberapa fluorin, senyawa organik atau anorganik. Pada yang organik, khususnya yang memiliki efek farmakologis, ganti salah satu heteroátomos mereka dengan atom F meningkat (secara positif atau negatif) tindakannya pada tujuan biologisnya.
Itulah sebabnya di industri farmasi modifikasi beberapa obat selalu ada di atas meja dengan menambahkan atom fluorin.
Sangat mirip terjadi dengan herbisida dan fungisida. Fluor di dalamnya dapat meningkatkan tindakan dan efektivitasnya pada serangga dan hama jamur.
Ukiran kaca
Asam fluorhorat, karena agresivitasnya dengan kaca dan keramik, telah digunakan untuk merekam potongan -potongan yang tipis dan halus dari bahan -bahan ini; Biasanya dimaksudkan untuk pembuatan komputer mikro komputer, atau untuk lampu listrik.
Pengayaan Uranium
Salah satu penggunaan fluoride dasar yang paling relevan adalah membantu memperkaya uranium sebagai 235ATAU. Untuk melakukan ini, mineral uranium larut dalam asam fluorhorat, menghasilkan UF4. Fluorida anorganik ini kemudian bereaksi dengan f2, Untuk berubah menjadi UF6 (235Fiuh6 Dan 238Fiuh6).
Selanjutnya, dan melalui sentrifugasi gas, 235Fiuh6 Itu terpisah dari 238Fiuh6 dan kemudian teroksidasi dan disimpan sebagai bahan bakar nuklir.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Krämer Katrina. (2019). Struktur fluorin beku terbalik setelah 50 tahun. Royal Society of Chemistry. Dipulihkan dari: ChemistryWorld.com
- Wikipedia. (2019). Fluor. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi. (2019). Fluor. Database pubchem. CID = 24524. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Kata. Doug Stewart. (2019). Fakta Elemen Fluor. Chemicool. Pulih dari: chemicool.com
- Batul Nafisa Baxamusa. (21 Februari 2018). Penggunaan yang mengejutkan dari fluor yang sangat reaktif. Pulih dari: sciencestruck.com
- Paola Opazo Sáez. (4 Februari 2019). Fluoride dalam pasta gigi: apakah baik atau buruk untuk kesehatan? Pulih dari: nacionfarma.com
- Karl Christe & Stefan Schneider. (8 Mei 2019). Fluor: Elemen Kimia. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Lentech b.V. (2019). Tabel periode: oksigen. Pulih dari: lentech.com
- Gagnon Steve. (S.F.). Elemen fluor. Jefferson Lab. Pulih dari: pendidikan.Jlab.org
- Tim Konten Medis dan Editorial American Cancer Society. (28 Juli 2015). Fluoridasi air dan risiko kanker. Pulih dari: kanker.org
- « Karakteristik sains yang tepat, apa yang Anda pelajari, contohnya
- Tidak ada sejarah logam, properti, grup, penggunaan »

