Struktur kalsium fluoride (CAF2), sifat, penggunaan

- 3612
- 819
- Ernesto Mueller
Dia kalsium fluoride Ini adalah padatan anorganik yang dibentuk oleh atom kalsium (CA) dan dua atom fluor (f). Formula kimianya adalah CAF2 Dan itu adalah solid abu -abu kristal.
Di alam itu ditemukan dalam bijih fluorit atau fluor spatter. Itu ada secara alami di tulang dan gigi. Mineral fluorit adalah sumber utama yang digunakan untuk mendapatkan senyawa fluor lainnya.
 CAF Kalsium fluoride2 padat. W: Pengguna: Walkerma pada Juni 2005. Sumber: Wikimedia Commons.
CAF Kalsium fluoride2 padat. W: Pengguna: Walkerma pada Juni 2005. Sumber: Wikimedia Commons. Selain itu kopi2 Ini digunakan untuk pencegahan karies pada gigi, sehingga ditambahkan ke bahan yang digunakan oleh dokter gigi untuk menyembuhkannya. Faktanya, kalsium fluoride juga ditambahkan ke air minum (air yang bisa diminum) sehingga populasi mendapat manfaat saat menelan dan menyikat gigi.
Kaf2 Ini digunakan dalam kristal besar dalam peralatan dan kamera optik. Ini juga digunakan dalam perangkat kecil yang berfungsi untuk mendeteksi seberapa banyak seseorang telah terpapar radioaktivitas.
[TOC]
Struktur
CAF Kalsium fluoride2 Ini adalah senyawa ionik yang dibentuk oleh kation kalsium Ca2+ dan dua fluoride-. Namun, beberapa sumber informasi menunjukkan bahwa tautan mereka memiliki karakter kovalen tertentu.
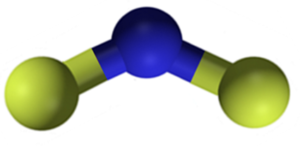 Struktur CAF Kalsium Fluoride2. Biru: kalsium; Fluor kuning. Claudio Pistilli [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Struktur CAF Kalsium Fluoride2. Biru: kalsium; Fluor kuning. Claudio Pistilli [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Tata nama
Kalsium fluoride
Properti
Keadaan fisik
Mewarnai padat hingga putih keabu -abuan dengan struktur kristal kubik.
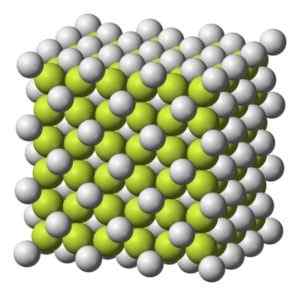 Struktur kopi kristal kubik2. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons.
Struktur kopi kristal kubik2. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons. Berat molekul
78.07 g/mol
Titik lebur
1418 ºC
Titik didih
2533 ºC
Kepadatan
3.18 g/cm3 pada 20 ° C.
Indeks bias
1.4328
Kelarutan
Itu tidak larut dalam air pada 20 ° C. Hampir tidak larut pada 25 ° C: 0,002 g/100 ml air. Sedikit larut asam.
Sifat kimia
Sifat pengoksidasi atau pereduksi sangat lemah, namun, reaksi ini dapat terjadi. Meskipun, biasanya, dalam beberapa kasus.
Ini inert terhadap senyawa kimia organik dan banyak asam, termasuk asam fluorhorat HF. Itu larut perlahan dalam asam nitrat3.
Dapat melayani Anda: Millikan Eksperimen: Prosedur, Penjelasan, PentingnyaItu tidak mudah terbakar. Tidak bereaksi dengan cepat dengan udara atau air.
Karena afinitasnya yang kecil terhadap air, meskipun terpapar dengan persentase kelembaban yang tinggi, itu tidak mempengaruhi bahkan selama sebulan pada suhu kamar normal.
Di hadapan kelembaban, dinding kristal mereka perlahan -lahan larut pada suhu di atas 600 ° C. Di lingkungan kering dapat digunakan hingga sekitar 1000 ° C tanpa terpengaruh.
Kehadiran di alam
CAF Kalsium fluoride2 Secara alami ditemukan dalam bijih fluorit atau spatter fluoride.
Meskipun kopinya2 Murni tidak berwarna, mineral fluorit sering diwarnai dengan adanya elektron yang terperangkap dalam "lubang" dari struktur kristal.
Mineral ini sangat dihargai karena kecerahan kaca dan variasi warna (ungu, biru, hijau, kuning, tidak berwarna, coklat, merah muda, hitam dan oranye kemerahan). Dikatakan sebagai "mineral paling berwarna di dunia".
 Fluorit tambang di Prancis. Toulouse Muséum [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Fluorit tambang di Prancis. Toulouse Muséum [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Fluorit (kristal biru) dari museum alami Milan. Giovanni dall'orto [cc by-sa 2.5 IT (https: // createveCommons.Org/lisensi/by-sa/2.5/IT/DEED.di dalam)]. Sumber: Wikimedia Commons.
Fluorit (kristal biru) dari museum alami Milan. Giovanni dall'orto [cc by-sa 2.5 IT (https: // createveCommons.Org/lisensi/by-sa/2.5/IT/DEED.di dalam)]. Sumber: Wikimedia Commons. Fluorit tambang di Inggris. Didier Descuens [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Fluorit tambang di Inggris. Didier Descuens [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Fluorit tambang di Prancis. Didier Descuens [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Fluorit tambang di Prancis. Didier Descuens [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
 Fluorit tambang di AS. Penulis: Oliveira Jurema. Sumber: Wikimedia Commons.
Fluorit tambang di AS. Penulis: Oliveira Jurema. Sumber: Wikimedia Commons. Kalsium fluoride juga ditemukan dalam tulang dalam jumlah antara 0,2 dan 0,65%, dan juga dalam enamel gigi di 0,33-0,59%.
Aplikasi
- Dalam mendapatkan senyawa fluoride
Fluorita Caf2 Ini adalah sumber dasar atau mayoritas fluoride di seluruh dunia. Itu adalah bahan baku untuk menyiapkan hampir semua senyawa fluorin.
Yang paling penting dari ini adalah asam fluorhororat HF, dari mana senyawa flowork lainnya disiapkan. Ion fluoride f- Dilepaskan dari mineral dengan reaksi ini dengan asam sulfat pekat H2Sw4:
Dapat melayani Anda: isomeriaKaf2 (solid) + h2Sw4 (cairan) → case4 (padat) + 2 hf (gas)
- Dalam perawatan gigi
CAF Kalsium fluoride2 Ini adalah agen untuk pencegahan karies. Ini digunakan untuk membuat fluora air yang bisa diminum (perairan yang bisa minum) dengan tujuan itu.
Selain itu, konsentrasi fluoride rendah f- (Urutan 0,1 bagian per juta) yang digunakan dalam pasta dan obat kumur telah terbukti memiliki efek positif yang mendalam pada perawatan gigi preventif karies.
 Kalsium fluoride membantu dalam pencegahan karies. Penulis: Annalise Batista. Sumber: Pixabay.
Kalsium fluoride membantu dalam pencegahan karies. Penulis: Annalise Batista. Sumber: Pixabay. Nanopartikel CAF2 lebih efektif
Meskipun fluorida digunakan dalam pasta gigi dan bilas, konsentrasi rendah kalsium (CA) dalam air liur menyebabkan endapan kopi tidak terbentuk2 di gigi dengan cara yang paling efektif.
Itulah mengapa cara mendapatkan debu kopi telah dirancang2 sebagai nanopartikel.
Untuk ini pengering digunakan oleh Rocío (dari bahasa Inggris Pengering semprot) Di mana dua solusi (satu dari Ca (OH) kalsium hidroksida2 dan salah satu amonium fluoride NH4F) Mereka bercampur saat disemprotkan dalam kamera dengan aliran udara panas.
Kemudian reaksi berikut terjadi:
CA (OH)2 + NH4F → CAF2 (solid) + NH4Oh
NH4Oh volatilisasi sebagai nh3 dan H2O Dan nanopartikel CAF tetap ada2.
Ini memiliki reaktivitas tinggi dan kelarutan yang lebih besar, yang membuatnya lebih efektif untuk seineralisasi gigi dan sebagai antikari.
- Dalam lensa untuk peralatan optik
Kalsium fluoride digunakan untuk membangun elemen optik seperti prisma dan spektrofotometer cahaya inframerah dan ultraviolet (UV).
Perangkat ini memungkinkan mengukur jumlah cahaya yang diserap oleh suatu bahan saat melewati itu.
Kaf2 Ini transparan di daerah ini dari spektrum cahaya, memiliki indeks pembiasan yang sangat rendah dan memungkinkan untuk mendapatkan resolusi yang lebih efisien daripada NaCl dalam interval 1500-4000 cm-1.
Dapat melayani Anda: paramagnetismeBerkat stabilitas kimianya dapat mendukung kondisi yang merugikan sehingga elemen optik CAF2 Mereka tidak diserang. Itu juga memiliki kekerasan tinggi.
Di kamera
Beberapa produsen kamera menggunakan lensa kopi2 Buatan mengkristal untuk mengurangi dispersi cahaya dan mencapai koreksi yang sangat baik dari distorsi warna.
 Beberapa kamera memiliki lensa kalsium fluoride CAF2 Untuk mengurangi distorsi warna. Bill Ebbesen [CC dengan 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]. Sumber: Wikimedia Commons.
Beberapa kamera memiliki lensa kalsium fluoride CAF2 Untuk mengurangi distorsi warna. Bill Ebbesen [CC dengan 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]. Sumber: Wikimedia Commons. - Di industri metalurgi
Kaf2 Ini digunakan sebagai agen pendiri dalam industri metalurgi, karena merupakan sumber kalsium yang tidak larut dalam air dan karenanya efektif dalam aplikasi yang sensitif terhadap oksigen.
Itu digunakan untuk meleleh dan memproses besi dan baja. Ini didasarkan pada fakta bahwa ia memiliki titik leleh yang mirip dengan besi dan juga bahwa ia dapat melarutkan oksida dan logam.
- Dalam detektor radioaktivitas atau radiasi berbahaya
Kaf2 Itu adalah bahan termoluminescent. Ini berarti bahwa ia dapat menyerap radiasi dalam elektron dari struktur kristal dan kemudian ketika dipanaskan untuk melepaskannya dalam bentuk cahaya.
Cahaya yang dipancarkan ini dapat diukur dengan sinyal listrik. Sinyal ini sebanding dengan jumlah radiasi yang diterima oleh material. Berarti semakin besar jumlah radiasi, semakin besar jumlah cahaya yang akan dipancarkan nanti saat dipanaskan.
Oleh karena itu CAF2 Ini digunakan dalam duaimeter pribadi yang disebut SO, yang digunakan oleh orang -orang yang terpapar radiasi berbahaya dan Anda ingin tahu berapa banyak radiasi yang telah mereka terima dalam periode waktu tertentu.
- Penggunaan lainnya
- Ini digunakan sebagai katalis dalam reaksi kimia dehidrasi dan dehidrogenasi untuk sintesis senyawa organik.
- Ini digunakan dalam elektroda alkali pengelasan. Pengelasan yang lebih kuat diperoleh dengan elektroda asam. Elektroda ini berguna dalam pembuatan kapal dan wadah baja bertekanan tinggi.
- Sebagai suplemen makanan dalam jumlah yang sangat rendah (ppm atau bagian per juta).
 Pengelasan pria. Elektroda dengan kopi kalsium fluoride2 Mereka membentuk lasan yang lebih kuat. William m. Piring jr. [Area publik]. Sumber: Wikimedia Commons.
Pengelasan pria. Elektroda dengan kopi kalsium fluoride2 Mereka membentuk lasan yang lebih kuat. William m. Piring jr. [Area publik]. Sumber: Wikimedia Commons. Referensi
- Pirmradian, m. dan hooshmand, t. (2019). Remineralisasi dan kemampuan antibakteri nanokomposit gigi berbasis resin. Sintesis dan karakterisasi kalsium fluoride (CAF2). Dalam aplikasi bahan nanokomposit dalam kedokteran gigi. Pulih dari scientedirect.com.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Kalsium fluoride. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- WEMAN, K. (2012). Pengelasan manual busur logam (MMA) dengan elektroda yang dilapisi. Dalam Buku Pegangan Proses Pengelasan (Edisi Kedua). Pulih dari scientedirect.com.
- Hanning, m. dan Hanning, c. (2013). Nanobiomaterial dalam kedokteran gigi preventif. Kalsium fluoride nanosized. Dalam nanobiomaterial dalam kedokteran gigi klinis. Pulih dari scientedirect.com.
- Ropp, r.C. (2013). Grup 17 (H, F, CL, BR, I) Senyawa Bumi Alkali. Kalsium fluoride. Dalam ensiklopedia senyawa bumi alkali. Pulih dari scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Valkovic, v. (2000). Pengukuran radioaktivitas. Dalam radioaktivitas di lingkungan. Detektor Themoluminescent (TLD). Pulih dari scientedirect.com.
- « Struktur Nitruro de Boro (BN), properti, memperoleh, menggunakan
- Struktur silikon oksida (SiO2), sifat, penggunaan, mendapatkan »

