Struktur silikon oksida (SiO2), sifat, penggunaan, mendapatkan

- 4056
- 652
- Domingo Gutkowski
Dia silikon oksida Ini adalah padatan anorganik yang dibentuk oleh penyatuan atom silikon dan dua oksigen. Formula kimianya adalah sio2. Senyawa alami ini juga disebut silikon atau silikon dioksida.
Sio2 Ini adalah mineral paling berlimpah di kerak bumi, karena pasirnya terdiri dari silika. Menurut strukturnya, silika bisa kristal atau amorf. Itu tidak larut dalam air, tetapi larut dalam alkalis dan asam fluorhorat HF.
 Pasir adalah sumber silikon dioksida sio2. ರವಿಮುಂ [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Pasir adalah sumber silikon dioksida sio2. ರವಿಮುಂ [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Sio2 Ini juga ada dalam struktur tanaman, bakteri, dan jamur tertentu. Juga dalam kerangka organisme laut. Selain pasir, ada juga jenis batu lain yang silika.
Silika memiliki penggunaan yang sangat luas untuk memenuhi berbagai fungsi. Penggunaan yang paling luas adalah sebagai bahan penyaringan cairan seperti minyak dan produk minyak, minuman seperti bir dan anggur, serta jus buah.
Tetapi memiliki banyak aplikasi lain. Salah satu yang paling berguna dan penting adalah dalam pembuatan kaca bioaktif, yang memungkinkan "perancah" di mana sel -sel tulang tumbuh untuk menghasilkan bagian tulang yang hilang karena kecelakaan atau penyakit.
[TOC]
Struktur
Silicio sio dioksida2 Ini adalah molekul tiga atom, di mana atom silikon terkait dengan dua atom oksigen dengan ikatan kovalen.
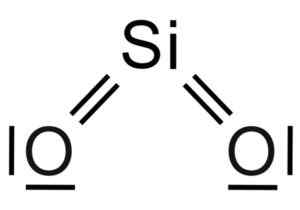 Struktur Kimia Molekul SIO2. Grasso Luigi [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Struktur Kimia Molekul SIO2. Grasso Luigi [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Unit struktural silika padat seperti itu adalah tetrahedron di mana atom silikon dikelilingi oleh 4 atom oksigen.
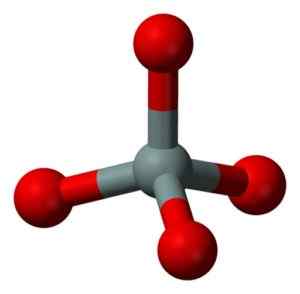 Unit struktural silika padat: abu -abu = silikon, merah = oksigen. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons.
Unit struktural silika padat: abu -abu = silikon, merah = oksigen. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons. Tetrahedra mengikat satu sama lain berbagi atom oksigen dari simpul yang berdekatan.
Itulah sebabnya atom silikon berbagi di masing -masing masing -masing dari 4 atom oksigen dan ini menjelaskan rasio dalam senyawa 1 atom silikon pada 2 atom oksigen (sio2).
 Tetrahedra berbagi oksigen di sio2. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons.
Tetrahedra berbagi oksigen di sio2. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons. Senyawa sio2 Mereka dibagi menjadi dua kelompok: silika kristal dan silika amorf.
Senyawa silika kristal memiliki struktur dengan pola berulang silikon dan oksigen.
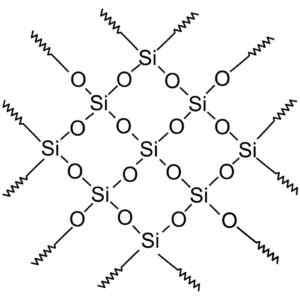 Silika kristal memiliki unit yang berulang. Wersję rastrową wykonał użytkownik polskiego projektu wikipedii: polyimerek, zwektoryzował: krzysztof zajączkowski [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Sumber: Wikimedia Commons.
Silika kristal memiliki unit yang berulang. Wersję rastrową wykonał użytkownik polskiego projektu wikipedii: polyimerek, zwektoryzował: krzysztof zajączkowski [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Sumber: Wikimedia Commons. Semua kristal silika dapat dianggap sebagai molekul raksasa di mana jaringan kristal sangat kuat. Tetrahedra dapat dihubungkan dengan berbagai cara, menimbulkan berbagai bentuk kristal.
Dapat melayani Anda: Jaringan Bravais: Konsep, Karakteristik, Contoh, LatihanDalam silika amorf, struktur tersebut terkait secara acak, tanpa mengikuti pola reguler antara molekul dan ini berada dalam hubungan spasial yang berbeda satu sama lain.
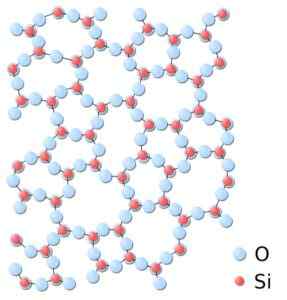 Dalam silika amorf, serikat pekerja tidak berulang atau seragam. Silika.SVG: *Silika.JPG: Dalam: Pengguna: JDrewittderivevative Work: Matt [Domain Publik]. Sumber: Wikimedia Commons.
Dalam silika amorf, serikat pekerja tidak berulang atau seragam. Silika.SVG: *Silika.JPG: Dalam: Pengguna: JDrewittderivevative Work: Matt [Domain Publik]. Sumber: Wikimedia Commons. Tata nama
-Silikon oksida
-Silikon dioksida
-Silika
-Kuarsa
-Tridimita
-Cristobalita
-Dioxosilano
Properti
Keadaan fisik
Warna tidak berwarna hingga abu -abu.
 Sampel sio2 murni. Lhchem [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Sampel sio2 murni. Lhchem [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Berat molekul
60.084 g/mol
Titik lebur
1713 ºC
Titik didih
2230 ºC
Kepadatan
2,17-2,32 g/cm3
Kelarutan
Tidak larut dalam air. Silika amorf larut dalam alkalis, terutama jika dibagi dengan halus. Larut dalam asam fluorhororat HF.
Silika amorf kurang hidrofilik, yaitu, kurang terkait dengan air daripada kristal.
Sifat kimia
Sio2 o Silika pada dasarnya inert untuk sebagian besar zat, sangat sedikit reaktif.
Menolak serangan klorin CL2, Bromo Br2, Hidrogen H2 dan sebagian besar asam pada suhu kamar atau sedikit lebih tinggi. Diserang oleh fluor f2, Asam fluorhororat HF dan alkali seperti natrium karbonat2BERSAMA3.
Sio2 Itu dapat dikombinasikan dengan elemen logam dan oksida untuk membentuk silikat. Jika silika meleleh dengan karbonat logam alkali pada sekitar 1300 ° C, silikat alkali diperoleh dan CO2.
Itu bukan bahan bakar. Ini memiliki konduktivitas termal yang rendah.
Kehadiran di alam
Sumber silika utama di alam adalah pasir.
Sio2 o Silika dalam bentuk tiga varietas kristal: kuarsa (yang paling stabil), tridimita dan cristobalita. Amorfant untuk silika adalah agata, jaspe dan Ónice. Opal adalah silika terhidrasi amorf.
Ada juga silika biogenik yang disebut SO, yaitu, yang dihasilkan oleh organisme hidup. Sumber jenis silika ini adalah bakteri, jamur, diatom, spons laut dan tanaman.
Bagian -bagian bambu yang cerah dan keras dan sedotan mengandung silika, dan kerangka beberapa organisme laut juga memiliki sebagian besar silika; Namun, yang paling penting adalah diatomator.
Tanah diatomea adalah produk geologis dari organisme uniseluler yang membusuk (alga).
Dapat melayani Anda: debu kosmikJenis silika alami lainnya
Di alam ada juga varietas berikut:
- Silikat vitreous yang merupakan kaca vulkanik
- Milleritas yang merupakan kaca alami yang diproduksi oleh perpaduan bahan silika di bawah dampak meteorit
- Silika cair yang dipanaskan silika ke cairan dan fase dingin tanpa memungkinkan kristal
Memperoleh
Silika dari arena diperoleh langsung dari tambang.
 Arena Quarry di California. Ruff Tux Cream Puff [CC0]. Sumber: Wikimedia Commons.
Arena Quarry di California. Ruff Tux Cream Puff [CC0]. Sumber: Wikimedia Commons. Diatomit atau diatom juga diperoleh dengan cara ini, menggunakan excavator dan peralatan yang serupa.
Silika amorf disiapkan berdasarkan larutan silikat logam alkali berair (seperti natrium na) dengan netralisasi dengan asam, seperti asam sulfat h2Sw4, Asam klorida HCl atau karbon dioksida2.
Jika pH akhir larutan adalah netral atau basa, silika yang diendapkan diperoleh. Jika pH adalah asam, gel silika diperoleh.
Silika pirogenik disiapkan dengan pembakaran senyawa silikon yang mudah menguap, biasanya silikon sicl tetrachloride4. Silika yang diendapkan diperoleh dari larutan silikat berair yang ditambahkan asam.
Silika koloid adalah dispersi stabil partikel koloid silika amorf dalam larutan berair.
Aplikasi
Dalam beberapa aplikasi
Silika atau sio2 Ini memiliki berbagai macam fungsi, misalnya berfungsi sebagai abrasif, penyerap, antiapelmazante, boneka, perburuan dan untuk mendukung suspensi zat lain, di antara banyak mode pekerjaan lainnya.
Itu digunakan misalnya:
-Dalam kaca, keramik, refraktori, pembuatan kaca yang abrasif dan larut
-Discoloration dan Pemurnian Minyak dan Produk Minyak
-Dalam cetakan untuk pengecoran
-Sebagai antiapelmazante bubuk dari semua jenis
-Sebagai antispumant
-Untuk menyaring cairan seperti pelarut cuci kering, air kolam dan air limbah kota dan industri
-Dalam pembuatan isolator panas, batu bata api dan bahan pengemasan yang tahan terhadap api dan asam
-Sebagai mengisi pembuatan kertas dan kartu, untuk membuatnya lebih tahan
-Seperti diisi dengan lukisan untuk meningkatkan aliran dan warnanya
-Dalam bahan untuk pemolesan logam dan kayu, karena mereka memberi mereka abrasif
-Dalam analisis kimia laboratorium dalam kromatografi dan penyerap
-Sebagai antiapelmazante dari insektisida dan formula agrokimia, untuk membantu menggiling pestisida dan sebagai pembawa senyawa aktif
-Sebagai dukungan katalis
-Sebagai mengisi untuk memperkuat karet dan karet sintetis
Dapat melayani Anda: gelombang longitudinal: karakteristik, perbedaan, contoh-Sebagai pembawa cairan dalam makanan hewani
-Di tinta cetak
-Sebagai pengering dan adsorben, dalam bentuk gel silika
-Sebagai aditif di semen
-Sebagai pasir hewan peliharaan
-Dalam isolator mikroelektronika
-Dalam sakelar termoptik
 Silika Gel. Kenpei [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]. Sumber: Wikimedia Commons.
Silika Gel. Kenpei [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]. Sumber: Wikimedia Commons. Di industri makanan
Silika amorf dimasukkan ke dalam berbagai produk makanan sebagai bahan langsung multifungsi dalam berbagai jenis makanan. Anda tidak boleh melebihi 2% dari makanan jadi.
Misalnya, ini berfungsi sebagai antiapelmazante (untuk mencegah makanan tertentu menempel), sebagai penstabil dalam produksi bir, sebagai antipresipitator, untuk menyaring anggur, bir dan jus buah atau sayuran.
 Tim untuk penyaringan anggur dengan diatom (SIO2). Fabio ingroso [cc by 2.0 (https: // createveCommons.Org/lisensi/oleh/2.0)]. Sumber: Wikimedia Commons.
Tim untuk penyaringan anggur dengan diatom (SIO2). Fabio ingroso [cc by 2.0 (https: // createveCommons.Org/lisensi/oleh/2.0)]. Sumber: Wikimedia Commons. Ini bertindak sebagai penyerap cair dalam beberapa makanan dan komponen mikrokapsul untuk penyedap minyak.
Selain itu sio2 amorf diterapkan melalui proses khusus pada permukaan plastik artikel untuk mengemas makanan, bertindak sebagai penghalang.
Di industri farmasi
Ini ditambahkan sebagai agen antiapelmazante, penebalan, gel dan eksipien, yaitu, sebagai asisten untuk membentuk beberapa obat dan vitamin.
Dalam industri kosmetik dan perawatan pribadi
Ini digunakan dalam banyak produk: dalam bubuk wajah, bayangan mata, eyeliner mata, lipstik, pewarnaan, tempat penampungan makeup, talcos, bubuk kaki, pewarna rambut dan pemutih dan pemutih.
Juga dalam minyak dan garam mandi, bak mandi, tangan dan krim tubuh.
Juga di krim hidrasi malam, kecerahan dan cat kuku.
Dalam aplikasi terapi
Sio2 Ini hadir dalam gelas bioaktif atau biovidrios yang karakteristik utamanya adalah bahwa mereka dapat bereaksi secara kimia dengan lingkungan biologis yang mengelilinginya, membentuk hubungan yang kuat dan tahan lama dengan jaringan hidup.
Jenis material ini berfungsi untuk membuat pengganti tulang seperti wajah, seperti "perancah" di mana sel -sel tulang akan tumbuh. Mereka telah menunjukkan biokompatibilitas yang baik dengan kedua tulang dan jaringan lunak.
Biovidrios ini akan memungkinkan untuk memulihkan tulang dari wajah ke orang yang kehilangan mereka secara tidak sengaja atau penyakit.
Risiko
Partikel silika yang sangat tipis dapat ditangguhkan di udara dan membentuk bubuk non -eksplosif. Tapi debu ini bisa mengiritasi kulit dan mata. Inhalasinya menyebabkan iritasi saluran pernapasan.
Selain itu, inhalasi debu silika menghasilkan kerusakan paru -paru jangka panjang, yang disebut silikosis.
Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Silikon dioksida. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Da silva, m.R. et al. (2017). Teknik ekstraksi hijau. Sorbnts berbasis silika. Dalam memahami kimia analitik. Pulih dari scientedirect.com.
- Ylänen, h. (editor). (2018). Kacamata Bioaktif: Bahan, Properti dan Aplikasi (Edisi Kedua). Elsevier. Pulih dari buku.Google.bersama.pergi.
- Windholz, m. et al. (Editor) (1983) Indeks Merck. Sebuah ensiklopedia bahan kimia, drarugs dan biologis. Edisi kesepuluh. Merck & Co., Inc.
- Mäkinen, j. Dan suni, t. (2015). Wafer SOI Film Tebal. Dalam Buku Pegangan Bahan dan Teknologi MEMS berbasis silikon (Edisi Kedua). Pulih dari scientedirect.com.
- Sirleto, l. et al. (2010). Sakelar termo-optik. Nanocrystals silikon. Pulih dari scientedirect.com.

