Struktur lithium fluoride, sifat, memperoleh, menggunakan

- 3653
- 490
- Tommie Smith
Dia Lithium fluoride Itu adalah padatan anorganik yang formula kimianya adalah life. Dibentuk oleh ion li+ dan f- yang disatukan melalui ikatan ionik. Ini ditemukan dalam jumlah kecil dalam beberapa mineral, terutama silikat seperti lepidolit, air laut dan di banyak sumur mineral.
Ini telah digunakan secara luas pada perangkat optik karena transparansi dalam berbagai panjang gelombang, dari spektrum inframerah (IR) ke UV ultraviolet, melalui yang terlihat.
 Lepidolit, mineral yang mengandung sejumlah kecil fluoride hidup. Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Lepidolit, mineral yang mengandung sejumlah kecil fluoride hidup. Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Ini juga telah digunakan pada perangkat untuk mendeteksi radiasi berbahaya dalam pekerjaan di mana orang terpapar ini untuk waktu yang singkat. Selain itu, digunakan sebagai bahan untuk melelehkan aluminium atau membuat gelas atau gelas kaca dan manufaktur keramik.
Itu berfungsi sebagai bahan untuk menutupi komponen baterai lithium dan untuk mencegah hilangnya awal pemuatan ini.
[TOC]
Struktur
Lithium fluoride adalah senyawa ionik, yaitu, dibentuk oleh penyatuan li kation+ dan anion f-. Kekuatan yang membuat mereka tetap bersama adalah elektrostatik dan disebut ikatan ionik.
Saat lithium digabungkan, ia memberikan elektron ke fluoride, keduanya lebih stabil daripada cara awal, seperti yang dijelaskan di bawah ini.
Elemen lithium memiliki konfigurasi elektronik berikut: [dia] 1s2 2s1 Dan saat memberikan elektron struktur elektronik seperti ini: [dia] 1s2 Mana yang jauh lebih stabil.
Elemen fluorin yang konfigurasi elektroniknya adalah: [ne] 1s2 2s2 2 p5, Dengan menerima elektron adalah bentuk [ne] 1s2 2s2 2 p6, lebih stabil.
Tata nama
- Lithium fluoride
- Fluorolitio
Dapat melayani Anda: oksida non -metalik- Lithium monofluoride
Properti
Keadaan fisik
Padatan putih, yang mengkristal dalam struktur kubik, seperti natrium klorida NaCl.
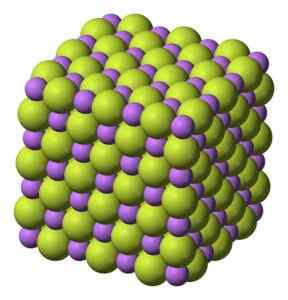 Struktur kubik kristal litium lithium fluoride. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons.
Struktur kubik kristal litium lithium fluoride. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons. Berat molekul
26 g/mol
Titik lebur
848.2 ºC
Titik didih
1673 ºC, meskipun diuapkan pada 1100-1200 ºC
Kepadatan
2.640 g/cm3
Indeks bias
1.3915
Kelarutan
Sedikit larut dalam air: 0,27 g/100 g air pada 18 ºC; 0,134 g/100 g pada 25 ºC. Larut dalam medium asam. Tidak larut dalam alkohol.
Properti lainnya
Uapnya memiliki spesies dimik (LIF)2 dan trimeric (lif)3. Dengan asam fluorhororat HF membentuk lihf lithium2; Dengan lithium hidroksida itu membentuk garam lif ganda.Lioh.
Memperoleh dan lokasi
LIF Lithium fluoride dapat diperoleh dengan reaksi antara asam fluorhororat HF dan Lioh lithium hidroksida atau lithium lithium karbonat2BERSAMA3.
Namun, ada dalam jumlah kecil dalam mineral tertentu seperti lepidolit dan air laut.
 Lithium fluoride ditemukan dalam jumlah kecil di air laut. Adeeb Atwan [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]. Sumber: Wikimedia Commons.
Lithium fluoride ditemukan dalam jumlah kecil di air laut. Adeeb Atwan [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]. Sumber: Wikimedia Commons. Aplikasi
Dalam aplikasi optik
LIF digunakan dalam bentuk kristal kompak dalam spektrofotometer inframerah (IR) karena dispersi yang sangat baik yang mereka miliki dalam interval panjang gelombang antara 4000 dan 1600 cm-1.
Kristal Life Life diperoleh dari larutan jenuh dari garam ini. Itu dapat menggantikan kristal fluorit alami di berbagai jenis perangkat optik.
Kristal besar dan murni digunakan dalam sistem optik untuk sinar ultraviolet (UV), monokromator IR dan X-ray (0,03-0,38 nm).
 Life Life Fluoruro Crystal, di dalam gelas kimia. V1adis1av [domain publik]. Sumber: Wikimedia Commons.
Life Life Fluoruro Crystal, di dalam gelas kimia. V1adis1av [domain publik]. Sumber: Wikimedia Commons. Ini juga digunakan sebagai bahan pelapis optik untuk daerah UV karena pita optiknya yang luas, lebih besar dari fluorida logam lainnya.
Itu dapat melayani Anda: logam alkalinoterrousTransparansi di UV yang jauh (90-200 nm) menjadikannya ideal sebagai lapisan pelindung di cermin aluminium (AL). Mirror LIF/AL telah digunakan dalam sistem teleskop optik untuk aplikasi ruang angkasa.
Pelapis ini dicapai dengan deposisi fisik uap dan deposisi lapisan pada tingkat atom.
Dalam pengion atau detektor radiasi berbahaya
Lithium fluoride telah banyak digunakan pada detektor termoluminesen untuk radiasi foton, neutron dan β (beta).
Detektor termoluminesen menjaga energi radiasi saat terpapar ini. Selanjutnya saat memanaskannya melepaskan energi yang disimpan dalam bentuk cahaya.
Untuk aplikasi ini, LIF umumnya bertanggal dengan pengotor magnesium (mg) dan titanium (TI). Kotoran ini menghasilkan tingkat energi tertentu yang bertindak sebagai lubang di mana elektron yang dilepaskan oleh radiasi terperangkap. Saat material kemudian dipanaskan, elektron -elektron ini kembali ke keadaan energi aslinya yang memancarkan cahaya.
Intensitas cahaya yang dipancarkan tergantung langsung pada energi yang diserap oleh material.
Detektor Thermoluminescent LIF telah berhasil diuji untuk mengukur bidang radiasi yang kompleks, seperti yang ada di Collider Hadron Besar, atau LHC (untuk akronimnya untuk bahasa Inggris Collider Hadron Besar), Terletak di Organisasi Eropa untuk Penelitian Nuklir, yang dikenal sebagai CERN (karena akronimnya dari Prancis Conseil Européen tuangkan nucleaire recherche).
Radiasi dalam pengalaman yang dilakukan di pusat penelitian itu menghadirkan hadrones, neutron dan elektron/positron, di antara jenis -jenis partikel subatomik lainnya, yang semuanya dapat dideteksi dengan LIF.
Sebagai bahan untuk prelite katoda baterai lithium
LIF telah berhasil diuji dalam bentuk nanokomposit dengan kobalt (CO) dan besi (iman) sebagai bahan untuk prelitiation (terjemahan bahasa Inggris Prelithiation) bahan katoda baterai lithium -ion.
Dapat melayani Anda: ethyl eterSelama siklus beban pertama atau tahap pembentukan baterai ion lithium, elektrolit organik dipecah untuk membentuk fase padat pada permukaan anoda.
Proses ini mengkonsumsi lithium katoda dan mengurangi energi antara 5 hingga 20% dari total kapasitas baterai ion lithium.
Untuk alasan ini, prelitiation elektrokimia katoda telah diselidiki, yang menghasilkan ekstraksi elektrokimia lithium nanokomposisi, yang bertindak sebagai donor lithium, sehingga menghindari konsumsi lithium katoda tersebut.
Nanocomposites LIF/CO dan LIF/FE memiliki kapasitas tinggi untuk menyumbangkan lithium ke katoda, mudah disintesis, stabil dalam kondisi pemrosesan lingkungan dan baterai.
 Baterai ion lithium. Penulis: MR.ちゅら さん. Lithium_battery * fotography day, Agustus, 2005 * fotografi orang aney. Sumber: Wikimedia Commons.
Baterai ion lithium. Penulis: MR.ちゅら さん. Lithium_battery * fotography day, Agustus, 2005 * fotografi orang aney. Sumber: Wikimedia Commons. Dalam beberapa kegunaan
Lithium fluoride digunakan sebagai meter pengelasan, terutama aluminium, dan pada pelapis batang pengelasan. Ini juga digunakan dalam sel reduksi aluminium.
Ini banyak digunakan dalam pembuatan kaca (seperti lensa) di mana koefisien ekspansi berkurang. Ini juga digunakan dalam pembuatan keramik. Selain itu, ia telah digunakan dalam pembuatan enamel dan pernis vitreous.
LIF adalah komponen bahan bakar untuk roket dan bahan bakar untuk jenis reaktor tertentu.
LIF juga digunakan dalam dioda pemancar cahaya atau komponen fotovoltaik, untuk injeksi elektron ke dalam lapisan internal.
Referensi
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Lithium fluoride. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah.
- OBRYK, b. et al. (2008). Respon berbagai jenis detektor lithium fluoride terhadap bidang radiasi campuran-anergy tinggi. Pengukuran Radiasi 43 (2008) 1144-1148. Pulih dari scientedirect.com.
- Matahari, dan. et al. (2016). Dalam Sintesis Kimia Situal Lithium Fluoride/Logam Nanokomposit untuk Prelithiation Kapasitas Tinggi Katoda. Nano Letters 2016, 16, 2, 1497-1501. Pulih dari pub.ACS.org.
- Hennessy, J. dan Nikzad, s. (2018). Deposisi lapisan atom pelapis optik lithium fluoride untuk ultraviolet. Anorganik 2018, 6, 46. MDPI pulih.com.
- « 10 Eksperimen Ilmiah untuk Sekunder Fisik, Kimia, Biologi
- Struktur asam metilmalonat, sifat, sintesis, penggunaan »

