Magnesium fosfat (MG3 (PO4) 2)
- 4440
- 731
- Frederick Pfeffer
 Struktur dan formula magnesium fosfat
Struktur dan formula magnesium fosfat Apa itu magnesium fosfat?
Dia Magnesium fosfat Ini adalah istilah yang digunakan untuk merujuk pada keluarga senyawa anorganik yang dibentuk oleh magnesium, logam alkali dan fosfat oxoanion. Magnesium fosfat paling sederhana memiliki formula kimia Mg3(PO4)2. Formula menunjukkan bahwa untuk setiap dua anion PO43- Ada tiga mg kation2+ berinteraksi dengan ini.
Juga, senyawa ini dapat digambarkan sebagai garam magnesium yang berasal dari asam ortofosfat (H3PO4). Dengan kata lain, magnesium "dikumpulkan" antara anion fosfat, terlepas dari presentasi anorganik atau organiknya (MGO, MG (tidak3)2, Mgcl2, Mg (oh)2, dll.).
Karena alasan ini, magnesium fosfat dapat ditemukan sebagai beberapa mineral. Beberapa di antaranya adalah: catteite -mg3(PO4)2 · 22h2O-, Struvita -(NH4) MGPO4· 6h2Atau, yang mikrokristalnya terwakili dalam gambar superior-, holtedalita -mg2(PO4) (Oh) - dan bobierrite -mg3(PO4)2· 8h2SALAH SATU-.
Dalam kasus Bobierrite, struktur kristalnya adalah monoklinik, dengan agregat kristal dengan kipas dan mawar besar -besaran. Namun, magnesium fosfat ditandai dengan menunjukkan bahan kimia struktural yang kaya, yang berarti bahwa ion mereka mengadopsi banyak pengaturan kristal.
Bentuk magnesium fosfat dan netralitas bebannya
Magnesium fosfat berasal dari penggantian proton H3PO4. Saat asam ortofosfat kehilangan proton, ia tetap seperti ion dihidrogen fosfat2PO4-.
Cara menetralkan beban negatif untuk menyebabkan garam magnesium? Ya mg2+ Menghitung dua biaya positif, kemudian membutuhkan dua jam2PO4-. Dengan demikian, magnesium diácido fosfat diperoleh, mg (h2PO4)2.
Kemudian, ketika asam kehilangan dua proton, ion hidrogenfosfat tetap, HPO42-. Sekarang bagaimana menetralkan dua muatan negatif ini? Seperti MG2+ Anda hanya perlu dua muatan negatif untuk dinetralkan, berinteraksi dengan ion HPO tunggal42-. Dengan cara ini, magnesium asam fosfat diperoleh: mghpo4.
Dapat melayani Anda: magnesium oksida: struktur, sifat, nomenklatur, penggunaanAkhirnya, ketika semua proton hilang, anion fosfat tetap43-. Ini membutuhkan kation tiga mg2+ dan dari fosfat lain untuk berkumpul dalam padatan kristal. Persamaan Matematika 2 (-3) + 3 (+2) = 0 membantu untuk memahami proporsi stoikiometri ini untuk magnesium dan fosfat.
Sebagai hasil dari interaksi ini, tribasic magnesium fosfat diproduksi: mg3(PO4)2. Mengapa Tribasic? Karena dia mampu menerima setara dengan tiga H+ Untuk membentuk H lagi3PO4:
PO43-(AC) + 3H+(Ac) h3PO4(AC)
Magnesium fosfat dengan kation lain
Kompensasi biaya negatif juga dapat dicapai dengan partisipasi spesies positif lainnya.
Misalnya, untuk menetralkan PO43-, Ion k+, Na+, RB+, NH4+, dll., Mereka juga dapat menengahi, membentuk senyawa (x) mgpo4. Jika x sama dengan NH4+, Mineral struvite anhidrat terbentuk, (NH4) MGPO4.
Memberi. Berkat ini, banyak kristal magnesium fosfat dapat disintesis (NA3Rbmg7(PO4)6, Misalnya).
Struktur

Gambar superior menggambarkan interaksi antara ion MG2+ dan po43- yang menentukan struktur kristal. Namun, itu hanya gambar yang menunjukkan geometri tetrahedral fosfat. Kemudian, struktur kristal menyiratkan fosfat dan magnesium spheres tetrahedra.
Dalam kasus MG3(PO4)2 Anhidrat, ion mengadopsi struktur rhombohedral, di mana mg2+ dikoordinasikan dengan enam atom O.
Di atas diilustrasikan pada gambar yang lebih rendah, dengan dimensi bahwa bola biru adalah kobalt, hanya mengubahnya untuk bidang hijau magnesium:
Dapat melayani Anda: Paduan Non -Lingkungan: Struktur, Properti, Penggunaan, Contoh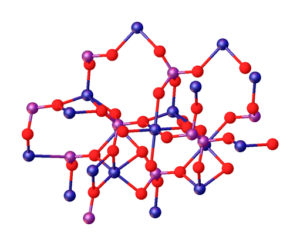
Tepat di tengah struktur, octaedro yang dibentuk oleh enam bola merah di sekitar bola kebiruan dapat ditempatkan.
Juga, struktur kristal ini mampu menerima molekul air, membentuk magnesium fosfat hidrat.
Ini karena mereka membentuk jembatan hidrogen dengan ion fosfat (hoh-o-po33-). Selain itu, setiap ion fosfat mampu menerima hingga empat jembatan hidrogen; yaitu empat molekul air.
Seperti MG3(PO4)2 Ini memiliki dua fosfat, dapat menerima delapan molekul air (yang terjadi dengan mineral Bobierrit). Pada gilirannya, molekul air ini dapat membentuk jembatan hidrogen dengan orang lain atau berinteraksi dengan pusat MG positif2+.
Properti
Ini adalah piring belah ketupat kristal yang padat dan padat. Itu juga tidak memiliki bau dan rasa.
Ini sangat tidak larut dalam air, bahkan ketika panas, karena energi jaringan kristal yang hebat; Ini adalah produk dari interaksi elektrostatik yang kuat antara ion serbaguna Mg2+ dan po43-.
Yaitu, ketika ion serbaguna dan radio ioniknya tidak bervariasi dalam ukuran, padatan menunjukkan resistensi terhadap pembubarannya.
Meleleh ke 1184 ºC, yang juga merupakan indikasi interaksi elektrostatik yang kuat. Sifat -sifat ini bervariasi tergantung pada berapa banyak molekul air menyerap, dan jika fosfat dalam beberapa bentuk terprotonasi (HPO42- atau h2PO4-).
Penggunaan/Aplikasi
Pencahar
Ini telah digunakan sebagai pencahar untuk keadaan sembelit dan keasaman lambung. Namun, efek sampingnya yang berbahaya - dimanifestasikan oleh generasi diare dan muntah - telah membatasi penggunaannya. Selain itu, kemungkinan besar menghasilkan kerusakan pada saluran pencernaan.
Dapat melayani Anda: oksigen molekuler: struktur, sifat, penggunaanPerbaikan tulang
Penggunaan magnesium fosfat dalam perbaikan jaringan tulang saat ini sedang dieksplorasi, menyelidiki penerapan MG (h2PO4)2 sebagai semen.
Bentuk magnesium fosfat ini memenuhi persyaratan untuk ini: ini terbiodegradasi dan histokompatibel. Selain itu, penggunaannya dalam regenerasi jaringan tulang direkomendasikan untuk ketahanannya dan pengaturan cepat.
Materi untuk ortopedi
Penggunaan magnesium fosfat amorf (AMP) sedang dievaluasi sebagai semen ortopedi biodegradable dan non -eksotermik. Untuk menghasilkan semen ini, bubuk amp dengan alkohol polivinil dicampur, untuk membentuk dempul.
Dalam makhluk hidup
Fungsi utama magnesium fosfat adalah untuk berfungsi sebagai kontribusi MG untuk makhluk hidup. Elemen ini mengintervensi dalam berbagai reaksi enzimatik seperti katalis atau perantara, menjadi penting untuk hidup.
Kekurangan Mg pada manusia dikaitkan dengan efek berikut: penurunan kadar CA, gagal jantung, retensi NA, penurunan kadar K, aritmia, kontraksi otot yang berkelanjutan, muntah, mual, kadar hormon paratiroid yang bersirkulasi rendah dan kram menstruasi, rendah sirkulasi, lambung dan kram menstruasi, lambung yang rendah, lambung dan lambung, kram menstruasi, rendah sirkulasi, lambung dan lambung, diantara yang lain.
Referensi
- Penerbitan Data Mineral. (2001-2005). Bobierrite. Dipulihkan dari Handbookofmineralogy.org
- Sahar Mousa. (2010). Studi tentang sintesis bahan magnesium fosfat. Buletin Penelitian Fosfor Vol. 24, hlm 16-21.
- Wikipedia. (2018). Tribasic magnesium fosfat. Diterima dari.Wikipedia.org
- Pubchem. (2018). Magnesium fosfat anhidrat. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah
- Barbie, e., Lin, b., Goel, v.K. Dan bhaduri, s. (2016) Evaluasi semen ortopedi non-eksotermik magnesium fosfat (AMP) berbasis. Matras Biomedis. Volume 11 (5): 055010.
- Yu, dan., Yu, ch. Dan Dai, h. (2016). Persiapan semen tulang magnesium yang terdegrabil. Biomaterial regeneratif. Volume 4 (1): 231

