Struktur natrium fosfat, sifat, sintesis, penggunaan

- 1597
- 148
- Ernesto Mueller
Dia Sodium fosfat Itu adalah garam anorganik yang formula kimianya na3PO4. Ini juga menerima nama fosfat trisodi (sdt untuk akronimnya dalam bahasa Inggris: Trisodium fosfat), atau natrium fosfat tribasic, karena benar -benar tidak memiliki kemampuan untuk menyumbangkan ion hidrogen h+.
Saat menyinggung itu dengan cara jamak, natrium fosfat, ada pembicaraan tentang seluruh ringkasan garam, terhidrasi atau tidak, berasal dari interaksi elektrostatik antara NA+ dan PO43-. Beberapa garam ini bahkan terdiri dari natrium pirofosfat, atau polimer anorganik yang memiliki PO43- sebagai monomer.
 Kaca jam dengan kristal natrium fosfat. Sumber: Ondřej Mangl [domain publik]
Kaca jam dengan kristal natrium fosfat. Sumber: Ondřej Mangl [domain publik] Itulah sebabnya, kecuali suatu spesifikasi dibuat, itu akan selalu merujuk pada NA3PO4, Dan tidak untuk Nah2PO4, NA2HPO4, Na4P2SALAH SATU7 Tidak ada garam lainnya.
Gambar atas menunjukkan penampilan natrium fosfat, yang terlihat kristal putih mirip dengan garam atau meja biasa, atau dibeli sebagai bubuk putih amorf putih. Na3PO4 mampu membentuk beberapa hidrat, menjadi na3PO4· 12h2Atau yang paling dipasarkan.
Ini menemukan penggunaan terutama di industri makanan, di deterjen, suplemen olahraga, dan berfungsi sebagai pencahar hiperosmotik.
[TOC]
Struktur kimia
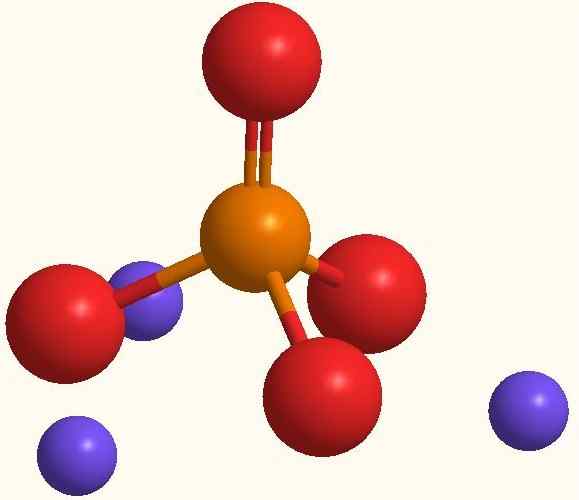 Ion utama natrium fosfat. Sumber: Smolamj via Wikipedia.
Ion utama natrium fosfat. Sumber: Smolamj via Wikipedia. Formula Na yang sama3PO4 menunjukkan bahwa untuk setiap anion PO43- Ada tiga kation na+. Ion -ion ini dapat diamati pada gambar superior. Perhatikan bahwa PO43- Ini memiliki geometri tetrahedral, dengan atom oksigennya membawa beban negatif resonansi, yang menarik NA+ lingkungan.
Juga, formula NA3PO4 Dia menunjukkan bahwa itu adalah garam anhidrat, jadi tidak ada molekul air yang termasuk dalam kristal mereka. Atraksi elektrostatik antara NA+ dan PO43- Mereka akhirnya mendefinisikan kristal putih trigonal. Tautan ioniknya sedemikian rupa sehingga na3PO4 Ini memiliki titik fusi 1583 ºC, jauh lebih tinggi dari beberapa garam.
Dapat melayani Anda: Reaksi Cannizzaro: Karakteristik, Mekanisme, ContohKeduanya na+ Seperti po43- Mereka adalah ion yang dapat terhidrasi dalam tingkat tinggi, tanpa berdampak negatif terhadap stabilitas kristal.
Karena alasan inilah hidrat juga dapat mengkristal; Namun, titik lelehnya lebih rendah daripada garam anhidrat, karena jembatan hidrogen antarmolekul air memisahkan ion dan melemahkan interaksi mereka. Di na3PO4· 12h2Atau, misalnya, titik lelehnya adalah 73,4 ºC, jauh lebih sedikit dari Na3PO4.
Properti
Penampilan fisik
Itu dapat terjadi sebagai kristal putih yang ditentukan atau sebagai debu atau butiran dengan warna yang sama. Semua magnitudo fisik yang diekspresikan di bawah hanya menyinggung garam naif3PO4.
Titik lebur
1583 ºC
Titik didih
100 ºC
Kelarutan air
14,5 g/100 mL pada 25 ° C, jadi dianggap sebagai air fosfat yang cukup larut. Namun, tidak larut dalam pelarut organik seperti etanol dan karbon disulfida.
Kepadatan
2.536 g/cm3 pada 17,5 ºC.
Stabilitas
Itu adalah padatan higroskopis. Oleh karena itu, harus disimpan sedemikian rupa sehingga tidak dapat terpapar kelembaban.
ph
Itu adalah garam yang sangat basa. Misalnya, larutan airnya 0,1% sudah memiliki pH 11,5. Properti ini berfungsi untuk digunakan sebagai aditif dalam deterjen.
Perpaduan
Bagaimana natrium fosfat diproduksi atau disintesis? Untuk melakukan ini, ini didasarkan pada asam fosfat, h3PO4, atau dari garam fosfat natrium garam, nah2PO4.
Dalam sebagian besar sintesis, H lebih disukai3PO4. Dengan demikian, H bereaksi3PO4 Dengan basa yang menetralkan tiga kelompok OH, dengan mempertimbangkan bahwa asam ini juga dapat ditulis sebagai PO (OH)3.
Dapat melayani Anda: Saldo Subjek: Apa itu, Persamaan Umum, JenisBasis berdasarkan preferensi adalah natrium hidroksida, NaOH (di Jerman), tetapi juga layak (dan lebih murah) untuk menggunakan natrium karbonat atau abu sosa, na2BERSAMA3 (di Amerika Serikat). Persamaan untuk kedua reaksi netralisasi adalah:
Na2BERSAMA3 + H3PO4 → Na2HPO4 + BERSAMA2 + H2SALAH SATU
Na2HPO4 + NaOH → NA3PO4 + H2SALAH SATU
Perhatikan bahwa saat menggunakan NA2BERSAMA3 NA tidak diperoleh3PO4 tapi na2HPO4, yang membutuhkan netralisasi selanjutnya. Menjadi reaksi berair berarti, mengkristal NA3PO4· 12h2Atau, jadi harus dihitung untuk menghilangkan kadar airnya dan menyebabkan garam anhidrat.
Na3PO4· 12h2O Ditandai dengan "menggabungkan" kristal mereka dalam massa kompak yang sulit. Semakin kecil ukuran kristal mereka, semakin cepat kalsinasi akan.
Aplikasi
Makanan
 Sodium fosfat digunakan sebagai agen efervesen untuk memperluas peran atau kue kayu manis. Sumber: Pixabay.
Sodium fosfat digunakan sebagai agen efervesen untuk memperluas peran atau kue kayu manis. Sumber: Pixabay. Dalam menggunakan natrium fosfat tidak dapat dihindari untuk mencampur na3PO4 atau na3PO4· 12h2Atau, karena yang terakhir adalah hidrat yang paling dipasarkan. Sebagai contoh, salah satu dari keduanya memberikan ion yang tidak berbahaya (secara teori) untuk makanan yang ditambahkan, memperkaya mereka dari fosfat dan pada saat yang sama meningkatkan salinitas mereka.
Di salar daging, na3PO4· 12h2Atau termasuk untuk menjaga mereka tetap segar selama penyimpanannya. Ini juga ditambahkan sebagai zat pengemulsi sehingga campuran air-air tidak "dipotong", tetapi tetap bersatu; Dan sebagai regulator pH, karena membantu mengurangi keasaman makanan (termasuk sereal).
Dapat melayani Anda: kalsium silikat: sifat, struktur, mendapatkan, menggunakanSelain itu, digunakan untuk mengentalkan beberapa saus tomat, dan untuk kue atau roti (gambar superior). Yang terakhir adalah karena na3PO4· 12h2Atau cenderung melepaskan uap air, yang meningkatkan ukuran pori -pori massa tepung dan volume yang sama.
Deterjen
Natrium fosfat cukup mendasar untuk menyusun beberapa lemak atau minyak yang dengannya Anda memiliki kontak. Alkalinitasnya kemudian digunakan untuk meningkatkan aksi deterjen, selama permukaan ke kesengsaraan bukanlah logam, karena mereka dapat memburuknya.
Namun, produksi deterjen yang diperkaya dengan fosfat telah berkurang karena mereka menghasilkan eutrofikasi danau dan sungai dan, dengan itu, proliferasi ganggang yang menutupi permukaannya.
Ini juga telah digunakan untuk elaborasi desinfektan: NA3PO4· 1/4NAOCL · 11H2Atau, yang disiapkan menggunakan natrium hipoklorit, naocl, bukan naOH atau na2BERSAMA3 Untuk menetralkan h3PO4.
Obat
Na3PO4 Ini menginduksi buang air besar dengan bertindak sebagai pencahar hiperosmotik, yang diperlukan untuk membersihkan usus besar sebelum pasien menjalani kolonoskopi. Di sisi lain, itu juga telah digunakan (ditambahkan) dalam suplemen energi.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Pusat Nasional Informasi Bioteknologi. (2019). Trisodium fosfat. Database pubchem. CID = 24243. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Wikipedia. (2019). Trisodium fosfat. Diperoleh dari: di.Wikipedia.org
- Curran m.P. & Plosker g.L. (2004). Larutan natrium fosfat oral: Ulasan penggunaannya untuk pembersih kolorektal. Doi: 10.2165/00003495-200464150-00009
- Corey Whelan. (22 Desember 2017). Sodium fosfat. Pulih dari: healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Proses untuk produksi trisodium fosfat. Diperoleh dari: freepatentsSsonline.com
- Maryann Marks. (2018). Mengapa trisodium fosfat (sdt) ditambahkan ke makanan kita? Pulih dari: Theingredientguru.com

