Formula Molekuler Cara mengeluarkannya, contoh dan latihan
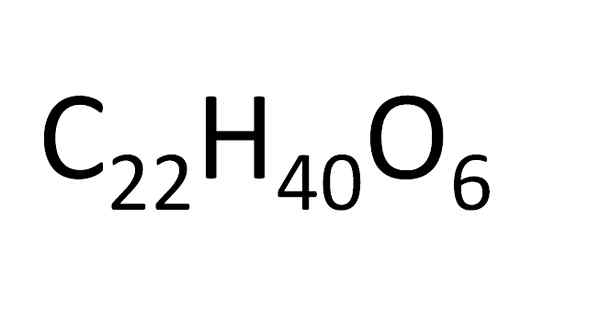
- 637
- 164
- Mr. Darrell Streich
Itu Formula molekul Ini adalah representasi dari molekul suatu senyawa, di mana mereka ditunjukkan, melalui simbol kimianya, atom dari semua elemen yang ada dalam senyawa dan jumlahnya. Setiap atom disertai dengan subskrip.
Formula molekuler memiliki batasan yang tidak menunjukkan hubungan dari berbagai atom molekul, atau hubungan spasialnya; seperti yang diungkapkan oleh formula struktural. Dalam beberapa kasus, ini tidak spesifik, misalnya: c6H12SALAH SATU6 Ini adalah formula molekul glukosa, galaktosa dan fruktosa.
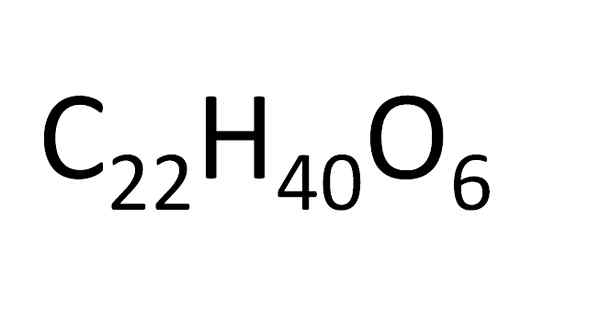 Dari formula molekul yang sama, senyawa isomer yang tak ada habisnya dapat diperoleh. Ini sesuai dengan variabel senyawa organik massa molekul tinggi. Sumber: Gabriel Bolívar.
Dari formula molekul yang sama, senyawa isomer yang tak ada habisnya dapat diperoleh. Ini sesuai dengan variabel senyawa organik massa molekul tinggi. Sumber: Gabriel Bolívar. Ada seperangkat aturan untuk pembuangan atom dalam formula molekuler. Untuk garam ionik, misalnya natrium klorida, simbol kation pertama kali ditempatkan (NA+) dan kemudian simbol anion (CL-). Inilah sebabnya mengapa formula molekul natrium klorida adalah NaCl.
Formula molekul senyawa organik ditulis dengan terlebih dahulu menempatkan simbol karbon (C), diikuti oleh simbol hidrogen (h) dan kemudian atom yang tersisa. Misalnya, formula molekul asam asetat adalah C2H4SALAH SATU2.
[TOC]
Cara Mendapatkan Formula Molekul
Memperoleh formula molekul suatu senyawa didasarkan pada pembentukan formula minimum atau empiris yang sama. Untuk alasan ini, langkah -langkah awal dalam mendapatkan kedua formula adalah umum.
Langkah pertama
Ekspresi massa unsur senyawa kimia dalam bentuk persentase biasa. Perhitungan sederhana kemudian harus dilakukan untuk mengubah persentase massa dari berbagai elemen menjadi massa mereka yang dinyatakan dalam gram.
Dapat melayani Anda: konsentrasi persentaseTahap kedua
Mengetahui massa dalam gram masing -masing elemen, dan massa atomnya, Anda dapat memperoleh jumlah relatif dari masing -masing atom atau jumlah mol dari masing -masing atom yang membagi massa masing -masing elemen yang berbeda antara massa atomnya.
Langkah ketiga
Jumlah relatif dari semua atom, antara jumlah relatif nilai lebih rendah. Nilai proporsi minimum harus bilangan bulat. Jika nilai proporsi mengandung desimal, koreksi harus dibuat yang membuat desimal seperti itu menghilang.
Koreksi terdiri dalam mengalikan semua nilai proporsi dengan angka yang kembali ke semua nilai. Misalnya, jika nilai proporsi minimum adalah 1.25, semua nilai harus dikalikan dengan empat (4). Sejak 1.25 dikalikan dengan 4 sama dengan 5, bilangan bulat.
Langkah Keempat
Semua simbol kimia dari unsur -unsur senyawa akan ditempatkan dan dengan subskrip yang sesuai; yaitu, nilai proporsi minimum elemen.
Langkah Kelima
Formula minimum suatu senyawa dapat diubah menjadi rumus molekulnya dengan memperoleh hubungan antara berat molekul senyawa dan berat formula minimumnya (N). Hubungan ini adalah sama yang ada antara formula molekul dan formula minimum.
n = berat molekul senyawa / berat formula minimum
Untuk mendapatkan rumus molekul, rumus minimum harus dikalikan dengan n. Ini menyiratkan bahwa masing -masing subskrip dari rumus minimum harus dikalikan dengan n.
n = berat molekul / berat formula minimum
= Formula molekul / rumus minimum
Dapat melayani Anda: oksigen: sifat, struktur, risiko, penggunaanRumus molekul = n · rumus minimum
Contoh formula molekuler
Di bawah ini adalah beberapa formula molekul umum:
-Ferrous oksida (jelek)
-Sodium hidroksida (NaOH)
-Kalium oksida (k2SALAH SATU)
-Oksida perklorik (CL2SALAH SATU7)
-Ferric Hydroxide [Faith (OH)3]
-Kalsium klorida (CACL2)
-Asam klorida (HCl)
-Sodium sulfat (n2Sw4)
-Asam sulfat (h2Sw4)
-Asam Perbromic (HBRO4)
-Aluminium klorida (ALCL3)
-Metana (ch4)
-Propana (c3H8)
-Etano (c2H6)
-Etil alkohol (c2H6SALAH SATU)
-Asam asetat (C2H4SALAH SATU2)
-Benzena (c6H6)
-Glukosa (c6H12SALAH SATU6)
Latihan terpecahkan
- Latihan 1
Metyl Benzoate memiliki persentase massa berikut:
C: 70,57 %,
H: 5,93 %
O: 23,49 %
Dan berat molekul 136,1 g/mol. Tentukan formula molekul.
Langkah pertama
Langkah pertama adalah mengekspresikan persentase massa elemen dalam massa mereka dalam gram, mengetahui bahwa persentase massa terkait dengan berat molekul.
Dari 136,1 gram yang sesuai dengan mol senyawa, 70,57% hanya mewakili karbon. Dan seterusnya dengan elemen yang tersisa:
Massa karbon = 136.1 g · (70.57/100)
= 96.05 g
Massa hidrogen = 136.1 g · (5.93/100)
= 8.06 g
Massa oksigen = 136.1 · (23.49/100)
= 31.96 g
Tahap kedua
Dalam elaborasi formula molekul, jumlah relatif atom (NRA) harus ditentukan. Untuk melakukan ini, massa unsur -unsur dibagi antara massa atomnya:
NRA (C) = 96 g / 12 g
= 8
NRA (h) = 8 g / 1 g
= 8 g
NRA (O) = 32 g / 16 g
= 2
Langkah ketiga
Kita kemudian harus menghitung proporsi minimum elemen (PME). Untuk ini, semua nilai NRA dibagi antara nilai NRA minor:
PME (c) = 8/2
= 4
PME (h) = 8/2
= 4
PME (O) = 2/2
= 1
Langkah Keempat
Tulis formula minimal metil benzoat, berdasarkan fakta bahwa subskrip elemen adalah proporsi minimal mereka dihitung:
Dapat melayani Anda: natrium dikromat (na2cr2o7): sifat, produksi, penggunaanC4H4SALAH SATU
Langkah Kelima
Akhirnya, formula molekul metil benzoat harus ditetapkan. Kami menghitung kemudian:
n = berat molekul / berat formula minimum
Berat formula minimum menjadi 68 g/mol:
= 136.1 g / 68 g
n ≈ 2
Rumus molekuler = 2 · Formula minimum
= 2 · c4H4SALAH SATU
Formula molekuler metil benzoat = C8H8SALAH SATU2
- Latihan 2
Persentase elemen yang membentuk benzena adalah sebagai berikut:
C: 92,36 %
H: 7,64 %.
Berat molekul benzena adalah 78 g/mol. Tentukan formula molekulnya.
Langkah pertama
Ubah persentase massa elemen menjadi massa mereka menjadi gram:
Massa karbon = 78 g · (92.36/100)
= 72.04 g
Massa hidrogen = 78 g · (7.64/100)
= 5.96 g
Tahap kedua
Perhitungan jumlah relatif atom (NRA). Untuk melakukan ini, massa unsur -unsur dibagi antara massa atomnya:
NRA (C) = 72 g / 12 g
= 6
NRA (h) = 6 g / 1 g
= 6
Langkah ketiga
Perhitungan nilai proporsi minimum elemen (PME). Ini dihitung dengan membagi nilai NRA dari semua elemen antara nilai NRA yang lebih rendah:
PME (c) = 6/6
= 1
PME (h) = 6/6
= 1
Langkah Keempat
Akta formula benzena minimum, dengan mempertimbangkan bahwa subskrip elemen adalah nilai proporsi yang dihitung minimum.
Formula benzena minimum: Ch
Langkah Kelima
Pembentukan formula molekul dengan menghitung hubungan antara massa molekul dan massa formula minimum:
n = berat molekul / berat formula minimum
= 78 g / 13 g
n = 6
Rumus molekul = n · rumus minimum
= 6 · ch
= C6H6
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Wikipedia. (2020). Formula Kimia. Diperoleh dari: di.Wikipedia.org
- Pembelajaran tanpa batas. (S.F.). Rumus molekuler. Pulih dari: kursus.Lumenarning.com
- Helmestine, Anne Marie, PH.D. (29 September 2019). Formula perhitungan empiris dan molekuler. Pulih dari: thinkco.com
- Peter J. Mikulecky, Chris Hren. (2020). Cara menggunakan formula empiris untuk menemukan formula molekuler. Pulih dari: boneka.com
- « Formula Minimum Cara Menghapus Formula Minimum, Contoh dan Latihan
- Sejarah Globalisasi, Karakteristik, Penyebab, Konsekuensi »

