Formula Minimum Cara Menghapus Formula Minimum, Contoh dan Latihan
- 2838
- 663
- Domingo Gutkowski
Itu Formula minimum atau empiris Ini adalah ekspresi proporsi di mana atom dari berbagai elemen yang membentuk senyawa kimia hadir. Formula minimum karenanya adalah representasi paling sederhana dari senyawa kimia. Untuk ini karena 'minimum'.
Formula minimum tidak mengekspresikan nomor atom dari berbagai elemen yang membentuk senyawa kimia; tetapi proporsi di mana atom -atom ini digabungkan untuk menghasilkan senyawa kimia.
 Formula minimal ini hampir tidak mengungkapkan bahwa senyawa ini memiliki jumlah karbon dan atom oksigen yang sama, dan atom hidrogen ganda. Sumber: Gabriel Bolívar.
Formula minimal ini hampir tidak mengungkapkan bahwa senyawa ini memiliki jumlah karbon dan atom oksigen yang sama, dan atom hidrogen ganda. Sumber: Gabriel Bolívar. Formula minimum juga disebut formula empiris, karena diperoleh dari eksperimen; yaitu, ini terkait dengan pengalaman. Pengamatan eksperimental diizinkan untuk menyimpulkan bahwa dua atom hidrogen dikombinasikan dengan atom hidrogen untuk membentuk air (h2SALAH SATU).
Dalam banyak kasus, formula minimum bertepatan dengan formula molekul. Dalam molekuler, jumlah nyata dari berbagai elemen yang membentuk senyawa kimia muncul; Begitulah yang terjadi, misalnya, asam sulfat (h2Sw4).
Tetapi dalam kasus lain, tidak ada kebetulan formula minimum dan formula molekul; Begitulah kasus benzena: formula minimum adalah CH, sedangkan formula molekulnya adalah C6H6.
[TOC]
Cara mendapatkan formula minimum?
Langkah pertama
Temukan gram dari setiap elemen yang ada di senyawa. Seperti biasanya dinyatakan sebagai persentase massa senyawa, perhitungan sederhana harus dilakukan untuk transformasi persentase massa elemen.
Tahap kedua
Jumlah relatif atom dari berbagai elemen yang membentuk senyawa kimia diperoleh. Untuk melakukan ini, massa setiap elemen dibagi, diekspresikan dalam gram, antara massa atomnya.
Beberapa penulis lebih suka memanggil jumlah relatif atom, seperti jumlah mol atom dari unsur -unsur yang merupakan bagian dari senyawa kimia.
Dapat melayani Anda: butanal: struktur, sifat, penggunaan dan risikoLangkah ketiga
Memperoleh proporsi minimum, dinyatakan dalam bilangan bulat, dari masing -masing atom yang ada dalam senyawa kimia.
Untuk menemukan nilai -nilai ini, jumlah relatif dari masing -masing atom yang ada dalam senyawa antara nilai numerik relatif bahwa atom dalam senyawa kimia dibagi.
Jika nilai proporsi minimum atom bukanlah bilangan bulat tanpa desimal, semua nilai proporsi minimum dengan angka harus dikalikan; Dengan cara ini, itu memungkinkan semua nilai proporsi minimum menjadi bilangan bulat.
Misalnya, jika nilai proporsi minimum atom senyawa kimia adalah 2.5, harus dikalikan semua nilai -nilai proporsi minimum masing -masing atom yang ada dengan 2. Dengan demikian, semua nilai proporsi minimum hanya akan menjadi bilangan bulat.
Langkah Keempat
Tulis formula senyawa minimum. Nilai proporsi minimum untuk atom dari elemen yang berbeda akan ditempatkan sebagai subskrip dari simbol kimia elemen untuk menulis formula minimum.
Contoh formula minimum
Air dan karbon dioksida
Kebanyakan senyawa kimia memiliki formula yang, pada saat yang sama, minimum dan rumus molekuler. Dengan demikian, formula air (h2O) adalah formula minimal; Tetapi juga formula molekul. Hal yang sama berlaku untuk formula karbon dioksida (CO2).
Oksida dasar dan asam
Oksida dan asam dasar adalah senyawa kimia yang memiliki formula kimia, kecuali kecuali untuk pengecualian yang merupakan formula minimal dan molekul. Situasi yang sama terjadi dengan hidroksida dan asam, kecuali untuk beberapa asam karboksilat.
Dapat melayani Anda: asetonitril (C2H3N)Asam asetat
Asam karboksilat yang memiliki sejumlah atom karbon dalam komposisinya, secara terpisah, formula minimal dan formula molekul. Asam asetat, misalnya, memiliki formula molekul (c2H4SALAH SATU2); Tetapi juga menyajikan formula minimal (Cho2SALAH SATU).
Asam butirat
Juga asam butirat memiliki formula molekul (c4H8SALAH SATU2) dan formula minimum (c2H4SALAH SATU).
Ethylene glycol
Senyawa organik lainnya memiliki dua jenis formula kimia; Begitulah kasus etilen glikol, yang memiliki formula molekul (c2H6SALAH SATU2) dan formula minimum (cho3SALAH SATU).
Benzena
Benzena, senyawa aromatik, memiliki formula molekul (c6H6) dan formula minimum (CH).
Glukosa
Glukosa memiliki formula molekul (c6H12SALAH SATU6) dan formula minimum (cho2SALAH SATU).
Latihan terpecahkan
- Latihan 1
Ethylene glycol adalah senyawa yang digunakan sebagai antibeku, memiliki berat molekul 62,1 g/mol dan komposisi persentase massa berikutnya:
C: 38 %,
H: 9,7 %
O: 51.16 %.
Langkah pertama
Mengungkapkan persentase massa elemen dalam massa mereka di gram. Untuk melakukan ini, berat molekul etilenglikol diambil sebagai referensi. Jika ini 62,1 gram per mol, 38% dari yang sama terdiri dari karbon. Dan seterusnya dengan elemen lain:
Massa karbon = 62.1 g · (38/100)
= 23.6 g
Massa hidrogen = 62.1 g · (9.7/100)
= 6.024 g
Massa oksigen = 62,1 g · (51,16/100)
= 31.77 g
Tahap kedua
Hitung jumlah relatif dari setiap atom saat ini (NRA) atau jumlah mol dari masing -masing atom. Untuk melakukan ini, massa masing -masing elemen kimia dibagi dengan massa atomnya.
NRA (C) = 23,6 g / 12 g
= 1.97
Itu bisa dibulatkan ke 2.
NRA (h) = 6.024 g / 1 g
= 6.024
Itu bisa dibulatkan pada pukul 6.
NRA (O) = 31,77 g /16 g
= 1.985
Itu bisa dibulatkan ke 2.
Langkah ketiga
Hitung proporsi minimum seluruh jumlah elemen senyawa (PMNE). Untuk melakukan ini, masing -masing nilai angka relatif atom (NRA) dibagi dengan nilai terendah dari ini. Dalam hal ini, 2.
Itu bisa melayani Anda: asam propanaPmne (c) = 2/2
= 1
Pmne (h) = 6/2
= 3
Pmne (o) = 2/2
= 1
Langkah Keempat
Tulis formula minimal etilen glikol:
Ch3SALAH SATU
Seperti dapat dilihat, nilai yang diperoleh pada Langkah 3 adalah subskrip dari elemen gabungan.
- Latihan 2
Asam asetat memiliki berat molekul 60 g/mol dan komposisi persentase massa berikut:
C: 40 %
H: 6,67 %
O: 53,33 %
Dapatkan formula senyawa minimum.
Langkah pertama
Mengubah persentase massa elemen menjadi massa mereka yang diungkapkan dalam gram:
Massa karbon = 60 g · (40/100)
= 24 g
Massa hidrogen = 60 g · (6,67/100)
= 4 g
Massa oksigen = 60 g · (53.33/100)
= 32 g
Tahap kedua
Hitung jumlah relatif atom (NRA) senyawa. Untuk melakukan ini, massa unsur -unsur dibagi antara massa atomnya:
NRA (C) = 24 g / 12 g
= 2
NRA (h) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Langkah ketiga
Dapatkan proporsi minimum seluruh jumlah elemen senyawa (PMNE). Untuk melakukan ini, nilai -nilai NRA dari elemen dibagi antara nilai NRA yang lebih rendah yang menghadirkan suatu elemen:
Pmne (c) = 2/2
= 1
Pmne (h) = 4/2
= 2
Pmne (o) = 2/2
= 1
Langkah Keempat
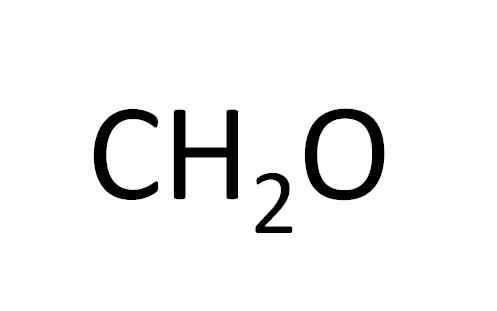
Tulis formula minimal asam asetat:
Ch2SALAH SATU
Subskrip senyawa adalah nilai yang diperoleh dari PMNE.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Helmestine, Anne Marie, PH.D. (27 Agustus 2019). Formula Empiris: Definisi dan Contoh. Pulih dari: thinkco.com
- Wikipedia. (2020). Formula empiris. Diperoleh dari: di.Wikipedia.org
- Libretteks Kimia. (3 Juli 2019). Rumus penghitungan empiris untuk senyawa. Pulih dari: chem.Librettexts.org
- Nicola McDougal. (2020). Formula Empiris: Definisi, Langkah & Contoh. Belajar. Pulih dari: belajar.com
- « Karakteristik dan contoh reaksi yang ireversibel
- Formula Molekuler Cara mengeluarkannya, contoh dan latihan »

