Kekuatan antarmolekul
- 1304
- 344
- Frederick Pfeffer
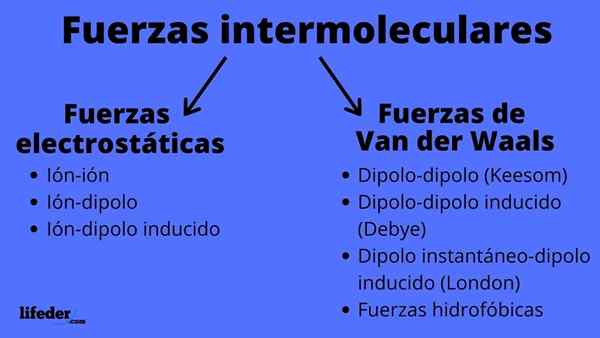 Skema tipe kekuatan antarmolekul
Skema tipe kekuatan antarmolekul Apa itu kekuatan antarmolekul?
Itu Kekuatan antarmolekul Mereka adalah seperangkat interaksi yang terjadi di antara molekul, apakah senyawa kimia yang sama atau tidak, dan yang membuatnya tetap bersama. Berkat pasukan ini, molekul berhasil mengelompokkan dan mendefinisikan padat, cair atau gas; yaitu, mereka bertanggung jawab atas sifat fisik zat.
Gaya antarmolekul dapat dari dua jenis: elektrostatik atau van der Waals. Yang elektrostatik adalah semua yang kami miliki, yang merupakan atom atau molekul yang dimuat secara elektrik (+ atau -). Sementara itu, orang -orang dari van der Waals melibatkan atom atau molekul netral, yang dengan fluktuasi distribusi elektroniknya terpolarisasi dan tertarik atau ditolak satu sama lain.
Kekuatan antar molekul dapat dibandingkan dengan persatuan yang ada di antara berbagai bagian orang awam. Bergantung pada bentuk dan pedoman mereka, serikat pekerja mereka menjadi lebih lemah atau lebih lemah, sama seperti mereka mengubah desain dan dimensi akhir konstruksi.
Semakin kuat kekuatan -kekuatan ini, semakin sulit untuk memisahkan potongan orang awam atau, dalam kasus kimia, molekul. Ini juga berarti bahwa akan ada pemadatan yang lebih besar dan, oleh karena itu, molekul akan menentukan lebih banyak cairan kental, gas yang lebih berat atau lebih padat.
Sifat fisik lainnya seperti fusi dan titik didih, volatilitas, tekstur, dll., Mereka juga merupakan refleks makroskopis dari kekuatan antarmolekul yang mengatur antara molekul atau ion senyawa atau campuran. Misalnya: kekuatan intermolekul gas sangat lemah dibandingkan dengan batu dari batu.
Memahami kekuatan antarmolekul sangat penting untuk menggambarkan banyak konsep kimia, fisik dan biologis.
Gaya elektrostatik
Ion-ion
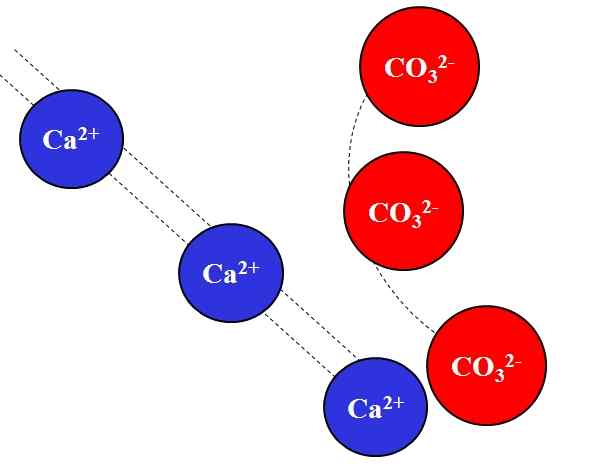 Daya tarik elektrostatik antara ion Ca2+ dan CO32-. Sumber: Gabriel Bolívar.
Daya tarik elektrostatik antara ion Ca2+ dan CO32-. Sumber: Gabriel Bolívar. Ion yang berlawanan dengan tuduhan menarik dengan kekuatan besar, yang disebabkan oleh hukum Coulomb, dan dengan cepat mengurangi semakin banyak ion yang menjauh.
Misalnya, ion CA2+ Itu adalah muatan positif, kation, sedangkan co32- Itu adalah ion beban negatif, anion. Menjadi beban yang berlawanan, CA2+ dan co32- Mereka saling menarik, membuktikan bahwa semakin dekat mereka, semakin banyak bersama mereka akan tetap ada.
Sebaliknya, ion dengan beban yang sama, baik positif atau negatif, tolak dengan kekuatan yang sama tetapi dalam arti yang berlawanan. Jadi, CA2+ Menolak ion seperti na+, Mg2+, K+, dll., Kecuali ada anion lain yang mengurangi tolakan.
Itu dapat melayani Anda: dibenzalacetona: sifat, mekanisme reaksi, penggunaan, risikoDari semua kekuatan antarmolekul, yang dari tipe ion-ion adalah yang paling sederhana; Tapi pada saat yang sama, yang terkuat dari semuanya. Banyak energi atau panas diperlukan untuk memisahkan ion.
Ion-Dipolo
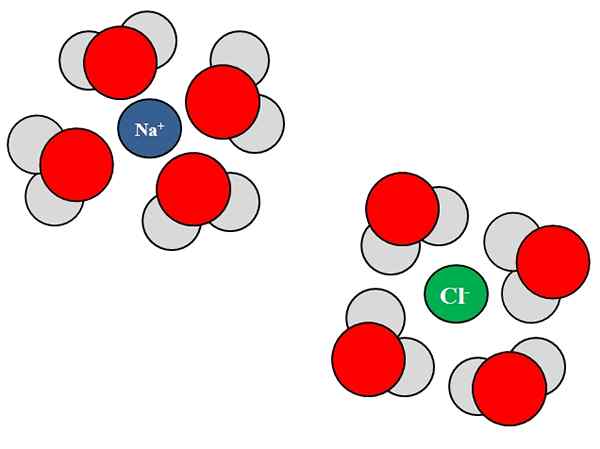 Interaksi ion-dipolo antara molekul air dan ion NaCl. Sumber: Gabriel Bolívar.
Interaksi ion-dipolo antara molekul air dan ion NaCl. Sumber: Gabriel Bolívar. Ion juga dapat berinteraksi dengan atom atau molekul netral, seperti air. Ini terutama benar ketika datang ke molekul pelarut, yang solvata, yaitu, mengelilingi ion di dalam cairannya.
Misalnya, natrium klorida, NaCl, terdiri dari ion Na+ dan Cl-. Saat kristal mereka dilemparkan ke dalam air, molekul air, h2O atau HOH, hidrat atau mengelilingi ion NaCl; Tetapi cara mereka bervariasi tergantung pada ion yang dimaksud.
Jadi, kita melihat dalam gambar superior bahwa ion na+ terhidrasi oleh atom oksigen h h2SALAH SATU. Sementara itu, ion cl- terhidrasi oleh atom hidrogen.
Karena? Karena air adalah zat kutub, yang berarti memiliki dipol: tiang dengan beban parsial positif, dan lainnya dengan beban parsial negatif.
Atom oksigen, karena lebih elektronegatif, menarik elektron ke arah diri mereka sendiri, sehingga menempatkan elektron lebih sering di sekitar atom itu; sesuatu yang tidak terjadi sama dengan atom hidrogen, lebih sedikit elektronegatif. Oksigen, karena lebih negatif, berorientasi pada na+; Sedangkan hidrogen, karena mereka lebih positif, berorientasi pada CL-, karena tuduhan yang berlawanan tertarik.
Ion-dipolo yang diinduksi
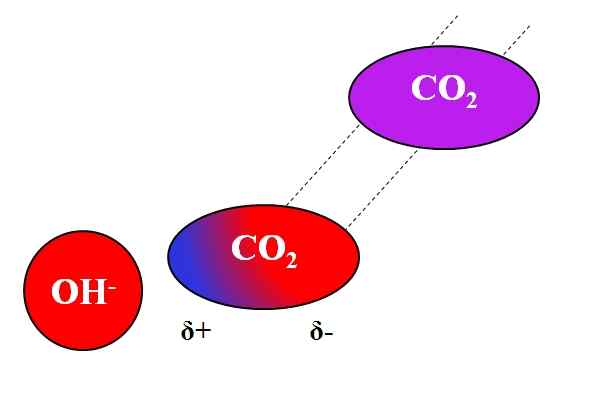 Tindakan induktif oh- pada molekul co₂. Sumber: Gabriel Bolívar.
Tindakan induktif oh- pada molekul co₂. Sumber: Gabriel Bolívar. Tidak hanya molekul kutub atau dipol yang dapat berinteraksi dengan ion. Untuk atom atau molekul netral, bahkan jika mereka tidak memiliki dipol, distribusi elektronnya rentan terhadap efek induktif ion di dekatnya; yaitu, ion menyebabkan polarisasi sesaat dan singkat, cukup untuk interaksi yang terkenal.
Dapat melayani Anda: Timbal Asetat: Struktur, Properti, Memperoleh, PenggunaanMisalkan misalnya interaksi antara oh ion- dan rekannya2. CO2 Ini adalah senyawa netral, yang molekulnya (dalam warna ungu) tidak memiliki dipol. Namun, saat OH mendekati-, Beban negatif dari ini mengusir elektron atom oksigen CO2.
Semakin dekat oh is- dan rekannya2, lebih kuat akan menjadi tolakan. Akibatnya, dipol yang disebabkan oleh OH mulai ditetapkan- Tentang co2. Kutub positif muncul Δ+ karena elektron, ditolak, "beremigrasi" ke ujung lain molekul.
Jadi, oh- dan rekannya2 Mereka tetap cukup bersama untuk bereaksi satu sama lain. Inilah alasan mengapa CO2 Itu sangat larut dalam solusi alkali.
Pasukan Van der Waals
Kekuatan van der Waals, pada prinsipnya, hanya merujuk pada yang ada antara atom atau molekul netral, tanpa beban ionik.
Dipolo-DiPolo (Keesom)
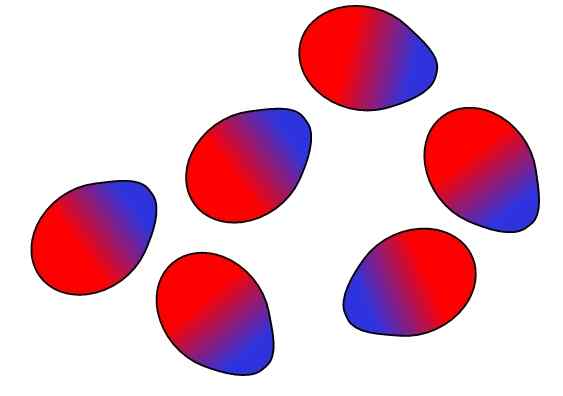 Pasukan Dipolo-DiPolo. Sumber: Gabriel Bolívar.
Pasukan Dipolo-DiPolo. Sumber: Gabriel Bolívar. Tuduhan yang berlawanan tertarik, beban yang sama mengusir. Hal yang sama berlaku untuk dipol: kutub yang berlawanan (Δ+ dan Δ-) tertarik, sementara kutub yang sama mengusir. Kutub positif atau Δ+ diwakili di atas dengan warna biru, namun kutub negatif atau Δ- diwakili dengan warna merah.
Perhatikan bagaimana molekul atas berorientasi dan dipesan sedemikian rupa sehingga kutub yang berlawanan, bergerak menjauh dalam proses ke kutub yang sama. Pemesanan ini adalah apa yang dikenal sebagai interaksi atau kekuatan dipolo-dipolo (gaya Keesom), dan merupakan kekuatan antarmolekul yang paling penting antara molekul kutub.
Misalnya, molekul H2Atau, hcl, hf, co, antara lain, mereka dipesan dalam mode yang sama. Semakin polar mereka, semakin kuat pasukan dipol-dipolonya; Dan karena itu, lebih sulit untuk memisahkan molekul mereka.
HF lebih kutub dari HCl, jadi titik didih HF lebih unggul (19.5 ºC) ke HCl (-85.05 ºC). Sungguh luar biasa efek yang dimiliki kekuatan antarmolekul pada sifat fisik. Variasi terkecil, dan zat itu akan berperilaku sama sekali berbeda dari apa yang diharapkan.
Dapat melayani Anda: Gaseous State: Karakteristik, Hukum Umum, ContohDipolo-dipolo (Debye) yang diinduksi
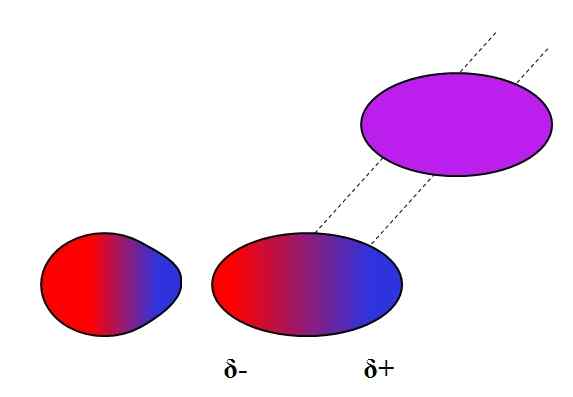 Dipolo-dipolo yang diinduksi. Sumber: Gabriel Bolívar.
Dipolo-dipolo yang diinduksi. Sumber: Gabriel Bolívar. Dipolos, seperti ion, juga dapat berfluktuasi atau mempengaruhi distribusi elektronik atom atau molekul netral. Jadi kita lihat, dalam gambar superior, bahwa dipol tiba -tiba mempolarisasi molekul netral. Oleh karena itu dikatakan bahwa itu adalah gaya dipol dipol yang diinduksi, karena dipol kedua adalah sesaat, bukan permanen.
Misalnya, air dapat melarutkan sejumlah kecil atau2, Tapi cukup untuk fauna laut untuk bernafas. Jika h2Atau tidak bisa menyebabkan dipol di o2, Semua oksigen laut akan lepas dari permukaan, karena tidak akan ada interaksi antara kedua molekul.
Dipolo Dipolo Dipolo (London) Instan (London)
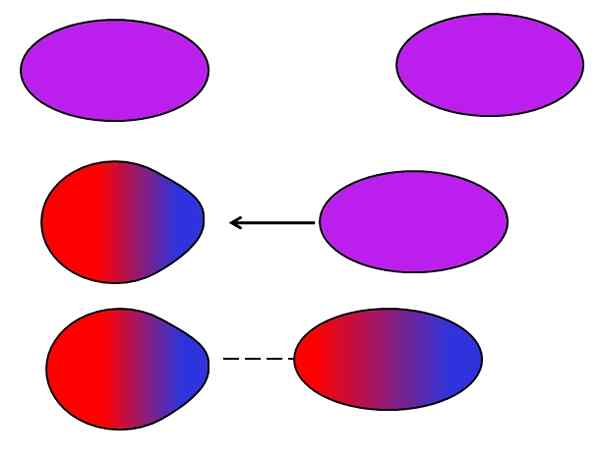 Pasukan London. Sumber: Gabriel Bolívar.
Pasukan London. Sumber: Gabriel Bolívar. Atom atau molekul netral tidak memerlukan ion tetangga atau dipol untuk menderita fluktuasi sendiri dalam distribusi beban internal mereka. Elektron tidak diam, tetapi bergerak di seluruh molekul. Pada titik tertentu, dipol instan akan terjadi, yang jika sangat dekat dengan molekul atau atom netral, akan menginduksi dipol di dalamnya (lihat di atas).
Semakin besar dan asimetris molekul -molekul ini, semakin besar kemungkinan dipol instan akan terjadi. Itulah sebabnya senyawa dari massa atom tertinggi memiliki kekuatan dipol instan yang diinduksi lebih kuat. Jenis Pasukan Van der Waals ini lebih dikenal sebagai Pasukan London.
Misalnya, gas mulia (dia, NE, AR, dll.) Mereka tetap bersatu berkat pasukan London, seperti halnya gas udara (atau2, N2, BERSAMA2, dll.). Juga, gaya ini adalah yang paling dominan di antara hidrokarbon seperti metana, cho4, Dan propana, cho3Ch2Ch3.
Kekuatan hidrofobik
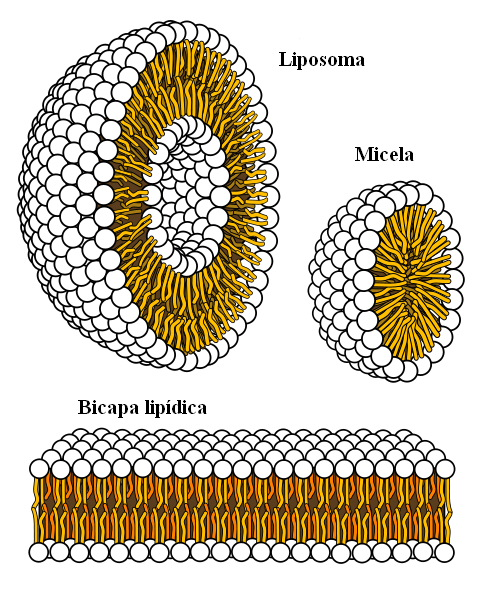 Struktur supramolekul berasal dari kekuatan hidrofobik
Struktur supramolekul berasal dari kekuatan hidrofobik Akhirnya, kami memiliki kekuatan hidrofobik, yang merupakan hasil khusus dari kekuatan London dan tolakan antar zat dengan polaritas yang berbeda. Lemak sedikit terkait dengan air, jadi tidak larut dalam hal ini.
Molekul lemak berusaha untuk mengelompok sedemikian rupa sehingga interaksi mereka dengan air sebanyak mungkin, dan ini berhasil membentuk struktur 3D seperti yang ditunjukkan di atas.
Dengan demikian, molekul lemak, seperti fosfolipid, bersatu untuk membentuk bilayer lipid, misel dan liposom.
Jika diamati, molekul -molekul ini memiliki kepala putih yang mewakili bagian kutub, terkait dengan air; serta ekor apolar, yang mengusir molekul air. Garis -garis berusaha menempatkan diri mereka di dalam struktur supramolekul ini, sehingga mereka tidak berinteraksi dengan air.

