Konsep, jenis dan contoh geometri molekuler
- 1847
- 441
- Tommie Smith
Itu Geometri molekuler salah satu struktur molekul Ini adalah distribusi spasial atom di sekitar atom sentral. Atom mewakili daerah di mana ada kepadatan elektronik yang tinggi, dan karenanya dianggap sebagai kelompok elektronik, terlepas dari tautan yang terbentuk (sederhana, ganda atau tiga)).
Geometri molekuler suatu elemen dapat mengkarakterisasi beberapa sifat fisik atau kimianya (titik didih, viskositas, kepadatan, dll.). Misalnya, struktur molekul air menentukan kelarutannya.
 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Konsep ini lahir dari kombinasi dan data eksperimental dari dua teori: yaitu Valencia Link (TEV) dan tolakan pasangan elektronik lapisan Valencia (RPECV). Sementara yang pertama mendefinisikan tautan dan sudutnya, yang kedua membentuk geometri dan, akibatnya, struktur molekul.
Bentuk geometris apa yang dapat mengadopsi molekul? Dua teori sebelumnya menyumbangkan jawaban. Menurut RPECV, atom dan pasangan elektron bebas harus diatur dalam ruang sedemikian rupa sehingga penolakan elektrostatik di antara mereka berkurang hingga maksimum.
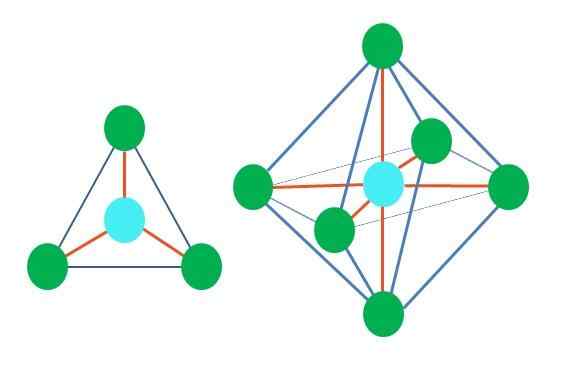
Jadi, bentuk geometris tidak sewenang -wenang, tetapi mencari desain yang paling stabil. Misalnya, pada gambar atas segitiga dapat dilihat di sebelah kiri, dan di sebelah kanan octahedron. Titik hijau mewakili atom dan garis oranye tautan.
Dalam segitiga, tiga titik hijau berorientasi pada pemisahan 120º. Sudut ini, yang sama dengan tautan, memungkinkan atom untuk saling mengusir. Oleh karena itu, molekul dengan atom sentral yang melekat pada tiga lainnya akan mengadopsi geometri trigonal datar.
Namun, RPECV memprediksi bahwa sepasang elektron bebas dalam atom pusat akan mendistorsi geometri. Dalam kasus bidang trigonal, torsi ini akan menekan tiga titik hijau, menghasilkan geometri piramida trigonal.
Hal yang sama juga dapat terjadi dengan octahedron gambar. Dalam semua atom dipisahkan dengan cara yang paling stabil.
[TOC]
Bagaimana mengetahui sebelumnya geometri molekuler atom x?
Untuk ini, juga perlu untuk mempertimbangkan elektron gratis sebagai kelompok elektronik. Ini, bersama dengan atom, akan menentukan apa yang dikenal sebagai Geometri elektronik, yang merupakan pendamping geometri molekuler yang tidak terpisahkan.
Dari geometri elektronik, dan setelah mendeteksi pasangan elektron bebas oleh struktur Lewis, dapat ditetapkan geometri molekul apa yang akan terjadi. Jumlah semua geometri molekuler akan memberikan sketsa struktur global.
Jenis geometri molekuler
Seperti dapat dilihat pada gambar utama, geometri molekuler tergantung pada berapa banyak atom yang mengelilingi atom pusat. Namun, jika beberapa elektron hadir tanpa berbagi, itu akan memodifikasi geometri karena menempati banyak volume. Oleh karena itu, itu memberikan efek sterik.
Menurut ini, geometri dapat menyajikan serangkaian bentuk karakteristik untuk banyak molekul. Dan di sinilah berbagai jenis geometri molekuler atau struktur molekul muncul.
Kapan geometri sama dengan struktur? Keduanya menunjukkan hal yang sama hanya dalam kasus di mana struktur tidak memiliki lebih dari satu jenis geometri; Kalau tidak, semua jenis yang ada harus dipertimbangkan dan memberikan struktur nama global (linier, bercabang, globular, datar, dll.).
Dapat melayani Anda: HidraceGeometri sangat berguna untuk menjelaskan struktur padatan dari unit strukturalnya.
Linear
Semua ikatan kovalen bersifat terarah, jadi tautan A-B linier. Tetapi akankah molekulnya menjadi linier2? Jika demikian, geometri direpresentasikan sebagai: b-a-b. Dua atom B dipisahkan oleh sudut 180º, dan menurut TEV, A harus memiliki orbital SP hibrida.
Angular
 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Geometri linier untuk molekul AB dapat diasumsikan pada contoh pertama2; Namun, penting untuk menarik struktur Lewis sebelum mencapai kesimpulan. Menggambar struktur Lewis, Anda dapat mengidentifikasi jumlah pasangan elektron yang tidak umum (:) pada atom a.
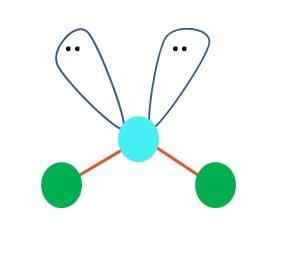
Saat demikian, pada pasangan elektron, dua atom B turun, mengubah sudut mereka. Akibatnya, molekul linier B-B akhirnya menjadi V, bumerang atau geometri sudut (gambar superior)
Molekul air, h-o-h, adalah contoh ideal untuk jenis geometri ini. Dalam atom oksigen ada dua pasang elektron tanpa berbagi yang berorientasi pada sudut perkiraan 109º.
Mengapa sudut ini? Karena geometri elektronik adalah tetrahedral, yang memiliki empat simpul: dua untuk atom H, dan dua untuk elektron. Dalam gambar superior, perhatikan bahwa titik hijau dan dua "lobus dengan mata" menggambar tetrahedron dengan titik kebiruan di tengahnya.
Jika OR tidak memiliki elektron bebas, air akan membentuk molekul linier, polaritasnya akan berkurang dan lautan, laut, danau, dll., Mereka mungkin tidak akan ada seperti yang mereka kenal satu sama lain.
Tetrahedral
 Sumber: Gabriel Bolívar
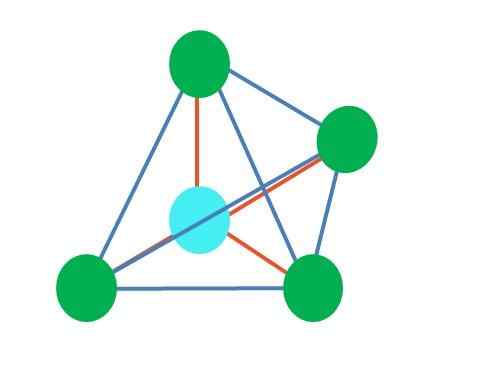
Sumber: Gabriel Bolívar Gambar atas mewakili geometri tetrahedral. Untuk molekul air, geometri elektroniknya adalah tetrahedral, tetapi dengan menghilangkan pasangan bebas elektron dapat dicatat bahwa ia diubah menjadi geometri sudut sudut. Ini juga hanya diamati dengan menghilangkan dua titik hijau; Dua yang tersisa akan menggambar V dengan titik biru.
Bagaimana jika alih -alih dua pasang elektron gratis hanya ada satu? Maka akan ada bidang trigonal (gambar utama). Namun, dengan menghilangkan kelompok elektronik, efek sterik yang dihasilkan oleh pasangan elektron bebas tidak dihindari. Oleh karena itu, ia mendistorsi bidang trigonal ke piramida dasar segitiga:
 Sumber: Gabriel Bolívar
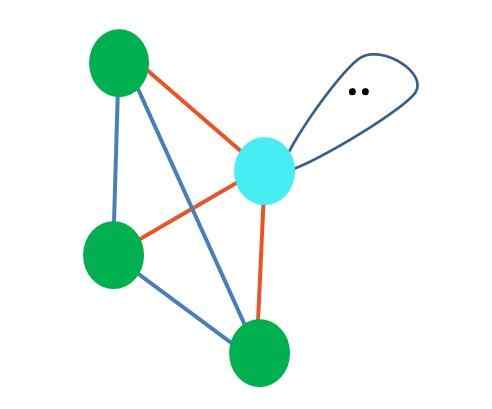
Sumber: Gabriel Bolívar Meskipun molekuler geometri trigonal dan piramida tetrahedral berbeda, geometri elektronik sama: tetrahedral. Jadi piramida trigonal tidak dianggap sebagai geometri elektronik?
Jawabannya adalah tidak, karena itu adalah produk dari distorsi yang disebabkan oleh "lobus dengan mata" dan efek steriknya, dan geometri tersebut tidak memperhitungkan distorsi nanti.
Untuk alasan ini, selalu penting untuk menentukan geometri elektronik pertama dengan bantuan struktur Lewis sebelum mendefinisikan geometri molekuler. Molekul amonia, NH3, Ini adalah contoh piramida trigonal geometri molekuler, tetapi dengan geometri elektronik tetrahedral.
Bipiramid Trigonal
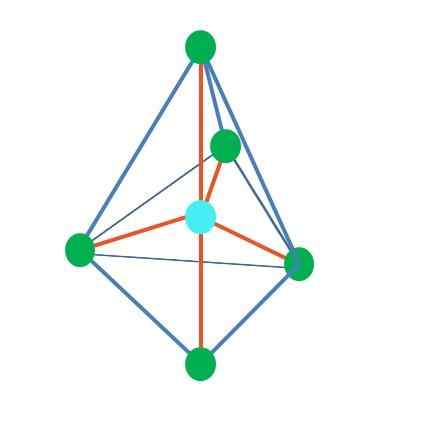 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Sampai sekarang, dengan pengecualian geometri linier, dalam piramida tetrahedral, sudut dan trigonal atom sentral mereka memiliki hibridisasi sp sp sp sp sp sp sp sp3, Menurut TEV. Ini berarti bahwa jika sudut tautannya ditentukan secara eksperimental, mereka harus sekitar 109º.
Itu dapat melayani Anda: kimia terapan: objek studi, cabang, pentingnya, contohDari geometri difarmidal trigonal, ada lima kelompok elektronik di sekitar atom pusat. Di gambar atas Anda dapat melihat dengan lima titik hijau; Tiga di dasar segitiga, dan dua dalam posisi aksial, yang merupakan simpul atas dan bawah piramida.
Hibridisasi apa yang kemudian memiliki titik biru? Perlu lima orbital hibrida untuk membentuk ikatan sederhana (oranye). Ini mencapainya melalui lima orbital SP3D (Produk campuran orbital S, tiga P dan satu D).
Saat mempertimbangkan lima kelompok elektronik, geometri sudah terpapar, tetapi memiliki pasangan elektron tanpa berbagi, ia kembali mengalami distorsi yang menghasilkan geometri lainnya. Demikian juga, pertanyaan berikut muncul: pasangan ini dapat menempati posisi piramida apa pun? Ini adalah: aksial atau ekuatorial.
Posisi aksial dan khatulistiwa
Titik hijau yang membentuk dasar segitiga berada pada posisi khatulistiwa, sedangkan keduanya di ujung atas dan bawah, pada posisi aksial. Di mana lebih disukai pasangan elektron akan ditemukan tanpa berbagi? Dalam posisi yang berkurang ke tolakan elektrostatik maksimum dan efek sterik.
Dalam posisi aksial, pasangan elektron akan membuat "tekanan" tegak lurus (90º) pada dasar segitiga, sementara jika berada dalam posisi khatulistiwa, kelompok elektronik yang tersisa dari dasar akan dipisahkan 120º dan tekan kedua ujungnya pada 90º (bukannya tiga, seperti halnya pangkalan).
Oleh karena itu, atom pusat akan berupaya memandu rekan -rekan bebas elektron dalam posisi khatulistiwa untuk menghasilkan geometri molekuler yang lebih stabil.
Berosilasi dan bentuk t
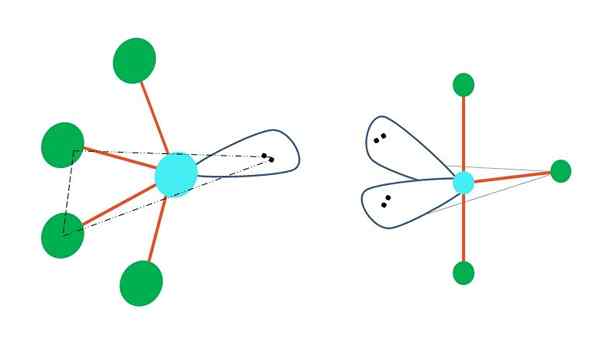 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Jika satu atau lebih atomnya bebas dari elektron diganti dalam geometri bipirramid trigonal, geometri molekul yang berbeda juga akan dimiliki.
Di sebelah kiri gambar atas, geometri berubah menjadi bentuk berosilasi. Di dalamnya, torsi bebas elektron mendorong sisa dari empat atom ke arah yang sama, menekuk tautan mereka ke kiri. Perhatikan bahwa torsi ini dan dua atom terletak pada bidang segitiga yang sama dari bipiramide asli.
Dan di sebelah kanan gambar, geometri dalam bentuk t. Geometri molekuler ini adalah hasil dari mengganti dua atom dengan dua pasang elektron, yang mengakibatkan tiga atom yang tersisa sejajar dalam bidang yang sama yang menarik huruf t persis.
Jadi, untuk molekul tipe AB5, Ini mengadopsi geometri bipyramid trigonal. Namun, AB4, Dengan geometri elektronik yang sama, ia akan mengadopsi geometri berosilasi; dan AB3, T -berbentuk geometri. Dalam semua dari mereka akan memiliki (umumnya) hibridisasi SP3D.
Untuk menentukan geometri molekuler, perlu menggambar struktur Lewis dan oleh karena itu geometri elektroniknya. Jika ini adalah bipiramid trigonal, pasangan bebas elektron kemudian akan dibuang, tetapi bukan efek steriknya pada sisa atom. Dengan demikian, itu dapat dilihat dengan sempurna di antara tiga geometri molekul yang mungkin.
Bersegi delapan
Di sebelah kanan gambar utama, geometri molekul oktahedral diwakili. Jenis geometri ini sesuai dengan senyawa AB6. AB4 Mereka membentuk dasar persegi, sedangkan dua posisi B yang tersisa sendiri di posisi aksial. Dengan demikian, beberapa segitiga sama sisi terbentuk, yang merupakan wajah Octahedron.
Dapat melayani Anda: energi aktivasiDi sini, sekali lagi, mungkin ada (seperti dalam semua geometri elektronik) pasangan elektron bebas, dan karenanya berasal dari fakta ini geometri molekuler lainnya. Misalnya, AB5 Dengan geometri elektronik octronistic itu terdiri dari piramida dengan basis persegi, dan AB4 dari pesawat persegi:
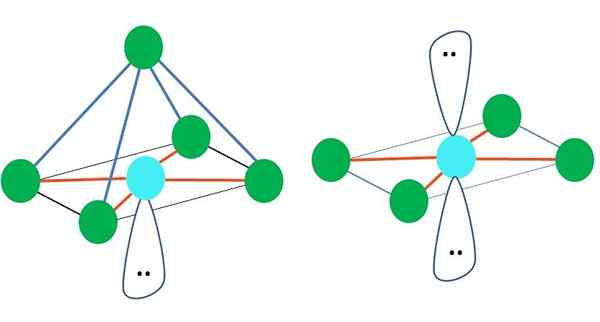 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Dalam kasus geometri elektronik octronistic, kedua geometri molekul ini adalah yang paling stabil dalam hal tolakan elektrostatik. Di geometri datar persegi, dua pasang elektron dipisahkan 180º.
Apa hibridisasi untuk atom dalam geometri ini (atau struktur, jika itu satu -satunya)? Sekali lagi, TEV menetapkan bahwa itu adalah SP3D2, Enam Orbital Hibrida, yang memungkinkan Anda memandu grup elektronik di simpul Octahedron.
Geometri molekuler lainnya
Memodifikasi basis piramida yang disebutkan sejauh ini, beberapa geometri molekul yang lebih kompleks dapat diperoleh. Misalnya, bipiramid pentagonal didasarkan pada pentagon dan senyawa yang membentuk formula umum ab7.
Seperti geometri molekuler lainnya, mengganti atom B dengan pasangan bebas elektron akan mendistorsi geometri ke bentuk lain.
Juga, senyawa AB8 Mereka dapat mengadopsi geometri seperti antiprisme persegi. Beberapa geometri bisa menjadi sangat rumit, terutama untuk formula AB7 Dari sekarang12).
Contoh geometri molekuler
Serangkaian senyawa akan disebutkan di bawah ini untuk masing -masing geometri molekul utama. Sebagai latihan, struktur Lewis dapat ditarik untuk semua contoh dan bersertifikat jika, mengingat geometri elektronik, geometri molekuler diperoleh karena terdaftar di bawah ini.
Geometri linier
-Ethylene, h2CunjungiCH2
-Beryllium chloride, becl2 (Cl-be-cl)
-Karbon Dioksida, CO2 (O = c = o)
-Nitrogen, n2 (Nop)
-Merkuri dibromure, hgbr2 (BR-HG-BR)
-Triyoduro anion, i3- (Aku aku aku)
-Asam Maddric, HCN (H-N-NILC)
Sudutnya harus 180º, dan karenanya memiliki hibridisasi SP.
Geometri sudut
-Air
-Belerang dioksida, jadi2
-Nitrogen dioksida, tidak2
-Ozon, atau3
-Amiduro Anion, NH2-
Flat trigonal
-Bromin Trifluoride, BF3
-Aluminium Trichloride, ALCL3
-Anion nitrat, tidak3-
-Anion karbonat, CO32-
Tetrahedral
-Gas Metano, CH4
-Karbon tetraklorida, CCL4
-Kation amonium, NH4+
-Anion sulfat, jadi42-
Piramida trigonal
-Ammonia, NH3
-Kation hidroni, h3SALAH SATU+
Bipiramid Trigonal
-Fosfor pentafluoruro, PF5
-Antimony Pentachloride, SBF5
Berosilasi
Sulfur tetrafluoride, SF4
Bentuk t
-Yodium trichloride, ICL3
-Klorin trifluorida, clf3 (Kedua senyawa ini dikenal sebagai interhalogen)
Bersegi delapan
-Hexafluoruro dari sulfur, sf6
-Selenium hexafluoruro, sef6
-Hexaflorophosphate, pf6-
Untuk memuncak, geometri molekuler adalah yang menjelaskan pengamatan sifat kimia atau fisik dari materi tersebut. Namun, itu berorientasi sesuai dengan geometri elektronik, sehingga yang terakhir harus selalu ditentukan sebelum yang pertama.
Referensi
- Whitten, Davis, Peck & Stanley. Kimia. (Edisi ke -8.). Pembelajaran Cengage, P 194-198.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat., P. 23, 24, 80, 169). MC Graw Hill.
- Tanda e. Tuckerman. (2011). Geometri Molekuler dan Teori VSEPR. Dipulihkan dari: NYU.Edu
- Virtual Chembook, Charles dan. Ophardt. (2003). Pengantar geometri molekuler. Dipulihkan dari: Kimia.Elmhursst.Edu
- Libretteks Kimia. (8 September 2016). Geometri molekul. Pulih dari: chem.Librettexts.org

