Karakteristik Globin, Struktur, Fungsi dan Perubahan
- 3734
- 1044
- Leland Robel
Itu Globin Ini adalah struktur sifat protein yang disusun dalam bentuk bola atau globular, dari mana namanya berasal. Struktur ini berupa tipe tersier dan ditandai dengan menjadi kompleks, karena rantai asam amino lipat untuk membentuk spheroprotein. Ada beberapa jenis rantai globin dan ini diklasifikasikan dalam huruf -huruf Yunani: Alfa, Beta, Delta, Gamma, Epsilon dan Zeta.
Asam amino yang membentuk struktur utama protein bervariasi sesuai dengan spesies yang dimiliki mereka (manusia atau hewan). Ada juga variasi dalam spesies yang sama sesuai dengan keadaan kehidupan organisme saat ini (kehidupan embrionik, kehidupan janin atau pasca kelahiran).
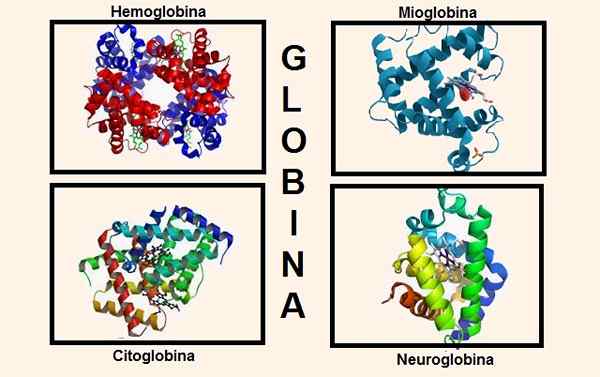
 Struktur berbeda yang mengandung globin dalam komposisinya. Sumber: Wikipedia.com/biancadescals [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]/Pengunggah asli adalah proteinboxbot di Wikipedia Inggris. [Domain publik]/wikipedia.com
Struktur berbeda yang mengandung globin dalam komposisinya. Sumber: Wikipedia.com/biancadescals [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]/Pengunggah asli adalah proteinboxbot di Wikipedia Inggris. [Domain publik]/wikipedia.com Informasi genetik untuk sintesis berbagai rantai globin terkandung dalam berbagai kromosom. Misalnya, alfa rantai globin ditemukan pada kromosom 16, sedangkan informasi genetik beta, delta, gamma dan epsilon ada pada kromosom 11.
[TOC]
Karakteristik
Globin adalah bagian dari struktur penting dalam tubuh, misalnya yang paling relevan adalah: hemoglobin dan mioglobin.
Hemoglobin mengandung empat rantai globin (Alfa 1 dan Alfa 2) dan (beta 1 dan beta 2). Setiap globin memiliki replikasi di mana ia melindungi kelompok hemo.
Di sisi lain, ada mioglobin. Yang memiliki struktur yang kurang kompleks dari hemoglobin. Ini menyajikan polipeptida globular tunggal yang disusun secara sekunder.
Sampai baru -baru ini diyakini bahwa ini adalah satu -satunya zat yang mengandung globin pada makhluk yang lebih tinggi, tetapi hari ini dua lagi diketahui yang memiliki globin dalam konstitusi mereka: sitoglobin dan neuroglobin.
Sitoglobin hadir di sebagian besar jaringan dan terutama terletak di jaringan ikat, serta telah ditemukan di retina.
Pada gilirannya, neuroglobin memiliki preferensi untuk jaringan saraf, karenanya namanya. Neuroglobin telah ditemukan di sel -sel saraf otak yang terletak di tingkat korteks serebral, serta di lokasi lain seperti thalamus, hipotalamus, hippocampus dan cerebellum.
Dapat melayani Anda: taksonomi linnean makhluk hidupNamun, mereka bukan satu -satunya lokasi, karena di luar sistem saraf dapat ditemukan di pulau Langerhans di pankreas dan di retina.
Struktur
Ada 6 jenis rantai globin yang ditunjuk dengan huruf -huruf alfabet Yunani: alfa (α), beta (β), gamma (γ), delta (δ), epsilon (ε) dan zeta (ζ). Rantai ini milik keluarga globinas, tetapi berbeda satu sama lain dalam jumlah asam amino yang mereka miliki.
Polipeptida ini memiliki struktur primer, sekunder dan tersier. Rantai asam amino sederhana mewakili struktur primer. Saat rantai digulung dengan membentuk spiral atau baling -baling membentuk struktur sekunder.
Jika struktur ini kemudian melipat berkali -kali, ia membentuk struktur globular yang sesuai dengan struktur tersier.
Demikian juga, mereka hanya dapat memperoleh bentuk kuaterner ketika 4 molekul atau rantai globin digabungkan dalam bentuk tersier.
Ini disajikan dalam struktur kompleks hemoglobin. Namun, dalam mioglobin itu berbeda. Dalam hal ini, globin disajikan sebagai monomer, yaitu, ia memiliki rantai peptida tunggal yang disusun dalam lipatan, menciptakan 8 baling -baling (struktur sekunder).
Baik hemoglobin dan mioglobin rumah kelompok hemo di dalam struktur kompleks mereka.
Hemoglobin
Dalam molekul ini, 2 rantai globin alfa dan 2 rantai beta bergabung. Beginilah cara mereka ditambah dengan sempurna untuk menampung kelompok hemo di tengahnya, ditambah besi.
Di antara struktur ini ada serikat pekerja yang lemah dan serikat pekerja yang kuat. Dalam serikat pekerja yang lemah, 19 asam amino berpartisipasi dan persatuan terjadi sebagai berikut: Rantai Alfa 1 bergabung dengan rantai beta 2 dan rantai Alfa 2 bergabung dengan rantai beta 1.
Sementara, 35 asam amino dan rantai yang bergabung adalah: rantai Alfa 1 bergabung dengan rantai beta 1 dan rantai Alfa 2 bergabung dengan rantai beta 2 2.
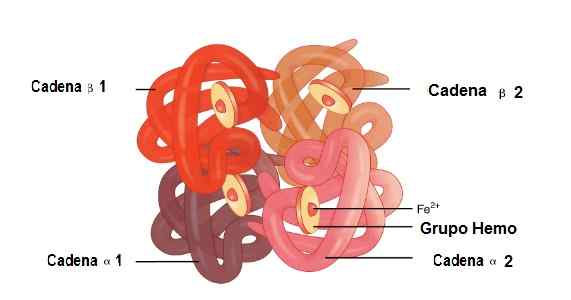 Lokasi rantai Alfa 1 dan Alfa 2, Beta 1 dan Beta 2 dalam struktur hemoglobin. Sumber: OpenX College [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)] gambar yang diedit (diterjemahkan ke dalam bahasa Spanyol)
Lokasi rantai Alfa 1 dan Alfa 2, Beta 1 dan Beta 2 dalam struktur hemoglobin. Sumber: OpenX College [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)] gambar yang diedit (diterjemahkan ke dalam bahasa Spanyol) Myoglobin
Pada mioglobin, kelompok protein globular juga ada, tetapi dalam hal ini ada rantai peptida tunggal yang terdiri dari 153 asam amino. Disposisi spasialnya adalah sekunder dan menyajikan 8 baling -baling alfa.
Itu bisa melayani Anda: oligoements: untuk apa mereka, untuk apa mereka dan apa ituStruktur protein ini secara strategis menempatkan asam amino hidrofobik ke dalam struktur, sedangkan asam amino hidrofilik atau polar ditemukan ke luar.
Desain ini sangat cocok untuk menampung kelompok hemo di dalam (bagian hidrofobik). Ini berikatan dengan protein dengan ikatan non -kovalen.
Cytoglobin
Itu ditemukan pada tahun 2001 dan dikatakan bahwa itu adalah jenis hemoglobin, tetapi berbeda karena heksakoordinasi, sedangkan hemoglobin dan mioglobin adalah pentacoordinated. Ini ada hubungannya dengan posisi yang diadopsi oleh asam amino histidin yang dekat dengan kelompok hemo.
Neuroglobin
Penemuannya dilakukan pada tahun 2000. Neuroglobin adalah monomer yang memiliki 150 asam amino, oleh karena itu sangat mirip dengan mioglobin. Struktur neuroglobin memiliki kesamaan antara 21 dan 25% dengan mioglobin dan hemoglobin.
Fungsi
Karena Globin tidak sendirian di dalam tubuh, tetapi menjadi bagian dari struktur tertentu, fungsi yang dipenuhi masing -masing dari mereka disebutkan:
Hemoglobin
Terletak di dalam eritrosit. Itu bertanggung jawab untuk memperbaiki dan mengangkut oksigen dari paru -paru ke jaringan. Serta tubuh karbon dioksida, membuat rute yang berlawanan.
Myoglobin
Kelompok hemo yang terletak di globin memiliki fungsi menyimpan molekul oksigen untuk mengoksidasi otot jantung dan otot rangka.
Cytoglobin
Protein ini diyakini mempengaruhi perlindungan hipoksia dan keadaan stres oksidatif dalam jaringan. Dipikirkan juga bahwa oksigen arteri dapat diangkut ke otak.
Neuroglobin
Diperkirakan bahwa neuroglobin memiliki kapasitas untuk memperbaiki oksigen, monoksida karbon dan oksida nitrat.
Namun, belum diketahui dengan pasti apa fungsi neuroglobin, tetapi diyakini bahwa itu terkait dengan regulasi hipoksia dan iskemia serebral. Terutama akan bertindak sebagai neuroprotector.
Dapat melayani Anda: teori transformasi lamarckKarena neuroglobin memiliki struktur yang mirip dengan hemoglobin dan mioglobin, itu berspekulasi bahwa ia dapat berpartisipasi dalam pasokan oksigen pada tingkat neuron. Dipercayai juga dapat menghilangkan radikal bebas dan nitrogen yang terjadi di rantai pernapasan.
Sehubungan dengan nitrat oksida, diperkirakan untuk menghilangkannya ketika oksigen normal dan memproduksinya dalam proses hipoksia dari yang tidak2.
Perubahan
Rantai globin alfa dan beta dikodekan oleh gen yang berbeda yang terletak pada kromosom 16 dan 11 masing -masing.
Individu yang memiliki hemoglobin (anemia falciform atau drapanocytic) memiliki cacat dalam rantai beta globin. Cacat terdiri dari penggantian basa nitrogen pada tingkat nukleotida nomor 20 gen yang terlibat, di mana ada perubahan adenin oleh timin.
Mutasi pada gen βS kromosom 11 berasal dari halop yang berbeda dari globinas yang disebut: Senegal, Kamerun, Benín, Bantú atau Mobil dan Asia atau Arab-India.
Mengetahui jenis haplotipe yang disajikan oleh pasien dengan anemia falciform adalah epidemiologis penting, karena memungkinkan untuk mengetahui distribusi haplotipe yang berbeda, tetapi juga informasi ini memberikan data penting untuk mengetahui prognosis penyakit tersebut.
Misalnya: Diketahui bahwa halotype bantu lebih serius, sedangkan tipe Senegal dan Asia lebih ringan.
Perbedaan antara haplotype dan lain terletak pada jumlah hemoglobin yang mereka miliki. Persentase hemoglobin F yang lebih tinggi dan prognosis hemoglobin yang lebih rendah. Lebih sedikit hemoglobin F dan lebih banyak prognosis hemoglobin yang lebih buruk.
Mutasi ini diwariskan secara otomatis bersama dengan mutasi hemoglobin.
Referensi
- "Globin." Wikipedia, ensiklopedia gratis. 19 Okt 2018, 13:44 UTC. 11 Jul 2019, 17:26, Wikipedia.org
- “Myoglobin." Wikipedia, ensiklopedia gratis. 7 Jul 2019, 21:16 UTC. 11 Jul 2019, 20:42, Wikipedia.org
- Durán C, Morales O, Echeverri S, Isaza M. Halotipe gen globin beta pada pembawa hemoglobin di Kolombia. Biomedis 2012; 32: 103-111. Tersedia di: Scielo.org
- Forrellat M, Hernández P. Neuroglobin: Anggota Baru Keluarga Globinas. Kuba Rev Immunol Hemother 2011; 27 (3): 291-296. Tersedia di: Scielo.Sld
- “Cytoglobin." Wikipedia, ensiklopedia gratis. 1 Sep 2017, 17:26 UTC. 12 Jul 2019, 00:28 Wikipedia.org
- « Karakteristik, struktur, fungsi heteropolysaccharides
- Gejala skizofrenia paranoid, penyebab dan perawatan »

