Fungsi glikolisis, enzim, fase, produk, kepentingan
- 750
- 164
- Ray Thiel
Itu Glikolisis o Glikolisis adalah rute katabolisme glukosa utama, yang tujuan utamanya adalah untuk mendapatkan energi dalam bentuk ATP dan NADH mengurangi daya, dari karbohidrat ini.
This route, completely elucidated in the 1930s by Gustav Embden and Otto Meyerhof while studying glucose consumption in skeletal muscle cells, consists of the complete oxidation of said monosaccharide and, by itself, represents an anaerobic pathway for the Obtaining energy.
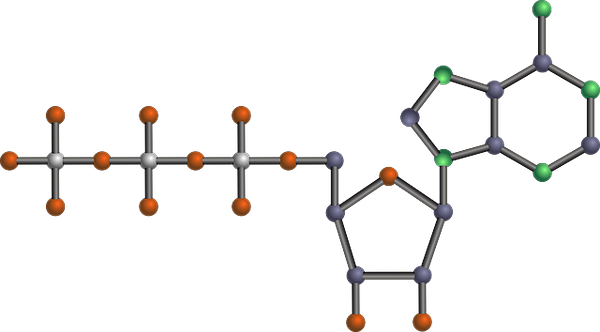
 Struktur molekul ATP, salah satu produk glikolitik (ringkasan jalur glikolitik (sumber: Tekks di Wikipedia Inggris/CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/3.0) Via Wikimedia Commons) Via Wikimedia Commons)
Struktur molekul ATP, salah satu produk glikolitik (ringkasan jalur glikolitik (sumber: Tekks di Wikipedia Inggris/CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/3.0) Via Wikimedia Commons) Via Wikimedia Commons) It is one of the main metabolic routes, because it occurs, with its differences, in all living organisms that exist, unicellular or multicellular, prokaryotes or eukaryotes, and it is thought that it is a chain of reactions very preserved evolutionarily in nature in nature.
Faktanya, ada beberapa organisme dan jenis sel yang bergantung secara eksklusif pada rute ini untuk bertahan hidup.
Dalam contoh pertama, glikolisis terdiri dari oksidasi glukosa, dari 6 atom karbon, menjadi piruvat, yang memiliki tiga atom karbon; Dengan produksi ATP dan NADH secara bersamaan, berguna untuk sel -sel dari sudut pandang metabolik dan sintetis.
Dalam sel -sel yang mampu memproses lebih lanjut produk yang diperoleh dari katabolisme glukosa, glikolisis berakhir dengan produksi karbon dioksida dan air melalui siklus Krebs dan rantai konveyor elektron (glikolisis aerobik).
Sepuluh reaksi enzimatik terjadi selama rute glikolitik dan, meskipun regulasi reaksi ini dapat menjadi sesuatu yang berbeda dari satu spesies ke yang lain, mekanisme regulasi juga cukup terpelihara.
[TOC]
Fungsi glikolisis
Dari sudut pandang metabolik, glukosa adalah salah satu karbohidrat terpenting untuk semua makhluk hidup.
Ini adalah molekul yang stabil dan sangat larut, sehingga dapat diangkut dengan relatif mudah di seluruh tubuh hewan atau tanaman, dari mana ia disimpan dan/atau diperoleh ke tempat yang dibutuhkan sebagai bahan bakar seluler.
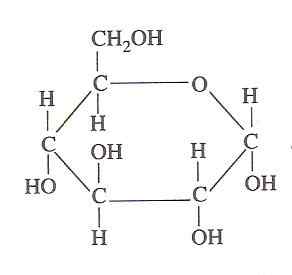 Struktur Glukosa (Sumber: Oliva93/CC BYS-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0) Via Wikimedia Commons)
Struktur Glukosa (Sumber: Oliva93/CC BYS-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0) Via Wikimedia Commons) Energi kimia yang terkandung dalam glukosa dieksploitasi oleh sel -sel hidup melalui glikolisis, yang terdiri dari serangkaian langkah yang sangat terkontrol di mana energi yang dilepaskan dari oksidasi karbohidrat ini dalam bentuk energi yang lebih dapat digunakan dapat "ditangkap", oleh karena itu kepentingannya.
Melalui rute ini, tidak hanya energi (ATP) dan pengurangan daya (NADH) diperoleh, tetapi juga menyediakan serangkaian perantara metabolisme yang merupakan bagian dari rute lain, juga penting dari anabolik (biosintesis) dan operasi seluler umum. Ini daftar:
- Glukosa 6-fosfat untuk rute pentosa fosfat (PPP, bahasa Inggris Pantos Mushco Pathway)
- Piruvat untuk fermentasi laktat
- Piruvat untuk sintesis asam amino (Alanine, terutama)
- Piruvat untuk siklus asam trikarboksilat
- Fruktosa 6-fosfat, glukosa 6-fosfat dan dihydroxyacetone fosfat, yang berfungsi sebagai "blok konstruksi" pada rute lain seperti sintesis glikogen, asam lemak, trigliserida, nukleotida, asam amino, dll.
Produksi energi
Jumlah ATP yang diproduksi oleh jalur glikolitik.
Namun, ketika datang ke sel aerobik, glikolisis juga bertindak sebagai sumber energi darurat dan berfungsi sebagai "langkah persiapan" sebelum reaksi fosforilasi oksidatif yang mengkarakterisasi sel dengan metabolisme aerobik.
Enzim yang berpartisipasi dalam glikolisis
Glikolisis hanya mungkin berkat partisipasi 10 enzim yang mengkatalisasi reaksi yang menjadi ciri rute ini. Banyak dari enzim ini adalah alosterik dan perubahan bentuk atau konformasi ketika mereka menjalankan fungsi katalitik mereka.
Ada enzim yang merusak dan membentuk ikatan kovalen di antara substratnya dan ada yang lain yang membutuhkan kofaktor spesifik untuk menjalankan fungsinya, terutama ion logam.
Secara struktural, semua enzim glikolitik memiliki pusat yang pada dasarnya dibentuk oleh lembaran β Paralel dikelilingi oleh Hellices α dan memesan di lebih dari satu domain. Selain itu, enzim ini ditandai karena situs aktifnya biasanya di situs serikat antara domain.
Penting juga untuk menyoroti bahwa regulasi utama rute melewati kontrol (hormonal atau metabolit) enzim seperti hexoquinase, fosfofrucerachinase, gliseraldehida 3-fosfat dehidrogenase dan piruvat kinase.
Dapat melayani Anda: parenkim paru: deskripsi, histologi, penyakit Titik regulasi utama jalur glikolitik.Org/lisensi/by-sa/3.0) Via Wikimedia Commons)
Titik regulasi utama jalur glikolitik.Org/lisensi/by-sa/3.0) Via Wikimedia Commons) 1- Hexoquinase (HK)
Reaksi pertama glikolisis (fosforilasi glukosa) dikatalisis oleh hexoquinase (HK), yang mekanisme aksi tampaknya terdiri dari "penyesuaian yang diinduksi" oleh substrat, yang mempromosikan "penutupan" enzim di sekitar ATP dan glukosa ( substratnya) Setelah mereka bergabung dengan ini.
Bergantung pada organisme yang dipertimbangkan, mungkin ada satu atau lebih isoenzim, yang beratnya molekulnya berkisar antara 50 (sekitar 500 asam amino) dan 100 kDa, karena tampaknya dikelompokkan dalam bentuk batas, yang pembentukannya disukai oleh adanya ion glukosa, magnesium dan ATP.
Hexoquinase memiliki struktur tersier yang terdiri dari alfa dan beta lembaran terbuka, meskipun ada banyak perbedaan struktural dalam enzim ini.
2- isomerase phosphoglucose (PGI)
Glukosa terfosforilasi oleh hexoquinase diisomerisasi menjadi 6-fosfat fruktosa dengan menggunakan isomerase fosfoglukosa (PGI), juga dikenal sebagai glukosa 6-fosfat isomerase. Enzim, kemudian, tidak menghilangkan atau menambahkan atom, melainkan mengatur ulang mereka di tingkat struktural.
Ini adalah enzim aktif dalam bentuk dimorisnya (monomer memiliki berat lebih atau kurang 66 kDa) dan terlibat tidak hanya dalam glikolisis, tetapi juga dalam glukoneogenesis, dalam sintesis karbohidrat pada tanaman, dll.
3- Phosphofrutequinase (PFK)
Fruktosa 6-fosfat adalah substrat untuk enzim fosfofrucerachinase, yang mampu melakukan fosforilasi lagi molekul ini menggunakan ATP sebagai donor gugus fosforil, menghasilkan fruktosa 1,6-bifosfat.
Enzim ini ada pada bakteri dan mamalia sebagai enzim homotrameric (terdiri dari empat subunit identik masing -masing 33 kDa untuk bakteri dan masing -masing 85 kDa dalam mamalia) dan dalam ragi itu adalah oktameter (terdiri dari subunit yang lebih besar, antara 112 dan 118 kDa).
Ini adalah enzim alosterik, yang berarti secara positif atau negatif diatur oleh salah satu produknya (ADP) dan molekul lain seperti ATP dan Citrate.
4- aldolase
Juga dikenal sebagai fruktosa 1,6-biffosfat aldolase, aldolase mengkatalisasi ruptur katalitik fruktosa 1,6-bifosfat dalam dihydroxyacetone phosphate dan gliseraldehida 3-fosfat dan reaksi reaksi, yaitu penyatuan kedua gula untuk pembentukan fromasi frukasi fruktosa 1.6.
Dengan kata lain, enzim ini memotong fruktosa 1,6-bifosfat hanya di tengah, melepaskan dua senyawa terfosforilasi dari 3 atom karbon. Aldolase juga terdiri dari 4 subunit yang identik, masing -masing dengan situs aktifnya sendiri.
The existence of two classes (I and II) of this enzyme has been determined, which differ by the mechanism of the reaction that catalyze and because some (the first) occur in "lower" bacteria and eukaryotes, and the others (the others ( yang kedua) adalah bakteri, protista dan metazoos.
Aldolase eukariota "superior" terdiri dari homotermeter subunit berat molekul 40 kDa, masing -masing dibentuk oleh barel yang terdiri dari 8 β/α lembaran.
5- triosa-fosfat isomerase (TIM)
Dua triosas terfosforilasi dapat saling berantakan satu sama lain berkat aksi isomerase triosa-fosfat, yang memungkinkan kedua gula untuk digunakan di seluruh glikolisis, memastikan penggunaan lengkap setiap molekul glukosa yang memasuki jalan.
Enzim ini telah digambarkan sebagai enzim "sempurna", karena mengkatalisasi reaksi yang dijelaskan sekitar satu miliar kali lebih cepat daripada yang akan terjadi tanpa partisipasinya. Situs aktifnya terletak di tengah struktur beta-barrel, karakteristik banyak enzim glikolitik.
Ini adalah protein dimérica, yang dibentuk oleh dua subunit identik sekitar 27 kDa, keduanya dengan struktur globular.
6- Gliseraldehida 3-fosfat dehidrogenase (GAPDH)
Gliseraldehida 3-fosfat yang diproduksi oleh aksi triosa-fosfat isomerase berfungsi sebagai substrat untuk GAPDH, yang merupakan enzim homoterramerik (34-38 kDa masing-masing subunit) yang secara kooperatif mengikat NAD+ molekul di masing-masing 4-nya. , serta 2 ion fosfat atau sulfat.
Dalam lorong rute ini, enzim memungkinkan fosforilasi salah satu substratnya menggunakan fosfat anorganik sebagai donor kelompok fosforil, dengan pengurangan dua molekul NAD+ secara bersamaan dan produksi 1,3-bifospphoglyceratato.
7- FOSFOGLYCERATO KINASE (PGK)
Fosfogliserat kinase bertanggung jawab untuk mentransfer salah satu gugus fosfat 1,3-bifosfogliserat ke molekul ADP karena fosforilasi pada tingkat substrat pada tingkat substrat. Enzim ini menggunakan mekanisme yang mirip dengan yang digunakan oleh hexoquinase, karena mendekati kontak pada substratnya, melindunginya dari molekul air interferensial.
Dapat melayani Anda: aponeurosis: karakteristik, fungsi, lokasiEnzim ini, seperti yang lain yang menggunakan dua atau lebih substrat, memiliki situs pengikatan untuk ADP dan lainnya untuk gula fosfat.
Berbeda dengan enzim lain yang dijelaskan, protein ini adalah monomer 44 kDa dengan struktur bilobular, terdiri dari dua domain dengan ukuran yang sama yang dihubungkan oleh "alur" yang sempit.
8- Mutase fosfoglikerat
3-fosfogliserasi mengalami perubahan dari gugus fosfat menjadi karbon 2, di tengah molekul, yang mewakili situs ketidakstabilan strategis yang memfasilitasi transfer kelompok berikutnya ke molekul ATP dalam reaksi terakhir rute tersebut.
Belakang ini dikatalisis oleh mutasa enzim fosfoglikerat, enzim dimérica untuk manusia dan tetrameric untuk ragi, dengan ukuran subunit mendekati 27 kDa.
9- enolase
Enolase mengkatalisasi dehidrasi 2-fosfoglikerat hingga fosfoenoliruvat, langkah yang diperlukan untuk generasi ATP dalam reaksi berikut.
Ini adalah enzim DiMérica yang terdiri dari dua subunit identik 45 kDa. Itu tergantung pada ion magnesium untuk stabilitas dan untuk perubahan konformasi yang diperlukan untuk bergabung dengan substrat Anda. Ini adalah salah satu enzim yang diekspresikan dengan kelimpahan yang lebih besar dalam sitosol banyak organisme dan menjalankan fungsi tambahan untuk glikolitik.
10- Quinasa puruvato
Fosforilasi kedua pada tingkat substrat yang terjadi dalam glikolisis dikatalisis oleh kinase piruvat, yang bertanggung jawab untuk transfer gugus fosforil fosfoenoliruvat ke ADP dan produksi piruvat.
Enzim ini lebih kompleks daripada enzim glikolitik lainnya dan pada mamalia itu adalah enzim homotram (57 kDa/subunit). Ada, pada vertebrata, setidaknya 4 isoenzim: L (di hati), R (dalam eritrosit), M1 (dalam otot dan otak) dan M2 (jaringan janin dan jaringan dewasa).
Fase glikolisis (langkah demi langkah)
Rute glikolitik terdiri dari sepuluh langkah berurutan dan dimulai dengan molekul glukosa. Selama proses tersebut, molekul glukosa "diaktifkan" atau "disiapkan" dengan penambahan dua fosfat, menginvestasikan dua molekul ATP.
Selanjutnya itu "dipotong" dalam dua fragmen dan akhirnya dimodifikasi secara kimia beberapa kali, mensintesis, di jalan, empat molekul ATP, sehingga gain bersih rute sesuai dengan dua molekul ATP.
Dari atas dapat disimpulkan bahwa rute dibagi menjadi fase "investasi" energi, mendasar untuk oksidasi lengkap molekul glukosa, dan fase lain dari energi "gain", di mana energi yang digunakan pada awalnya diisi ulang dan dua bersih ATP molekul.
- Fase Investasi Energi
1- Langkah pertama dari rute glikolitik terdiri dari fosforilasi glukosa yang dimediasi oleh hexoquinase (HK), yang enzim menggunakan molekul ATP untuk setiap molekul glukosa yang difosforilasi. Ini adalah reaksi yang tidak dapat diubah dan tergantung pada keberadaan ion magnesium (Mg2+):
Glukosa + ATP → glukosa 6-fosfat + ADP
2- 6-fosfat glukosa dengan demikian diproduksi diisomerisasi menjadi fruktosa 6-fosfat berkat aksi enzim isomerase fosfoglukosa (PGI) (PGI). Ini adalah reaksi yang dapat dibalik dan tidak menyiratkan pengeluaran energi tambahan:
Glukosa 6-fosfat → fruktosa 6-fosfat
3- Selanjutnya, langkah investasi energi lain menyiratkan fosforilasi fruktosa 6-fosfat untuk membentuk 1,6-bifosfat fruktosa. Reaksi ini dikatalisis oleh enzim fosfofrutequinase-1 (PFK-1). Seperti langkah pertama rute, molekul donator kelompok fosfat adalah ATP dan juga merupakan reaksi yang tidak dapat diubah.
Fruktosa 6-fosfat + ATP → fruktosa 1,6-biphosfat + ADP
4- Pada langkah glikolisis ini ada ruptur katalitik fruktosa 1,6-biphosfat dalam dihydroxyacetone phosphate (DHAP) A ketosis, dan dalam gliseraldehida 3-fosfat (gap) dan aldosa. Kondensasi aldolik ini dikatalisis oleh enzim aldolase dan merupakan proses reversibel.
Fruktosa 1,6-biffosfat → dihydroxyacetone phosphate + gliseraldehida 3-fosfat
5- Reaksi terakhir dari fase investasi energi terdiri dari interkonversi triosas DHAP fosfat dan celah yang dikatalisis oleh enzim triosa-fosfat isomerase (TIM), fakta yang tidak memerlukan kontribusi energi tambahan dan itu juga merupakan proses yang dapat dibalikkan.
Dihydroxyacetone phosphate ↔ gliseraldehida 3-fosfat
- Fase Penguatan Energi
6- 3-fosfat gliseraldehida digunakan "hilir" pada rute glikolitik sebagai substrat untuk reaksi oksidasi dan fosforilasi lain, dikatalisis oleh enzim yang sama, gliseraldehida 3-fosfat dehidrogenase (gapdh) gliseraldehida 3-fosfat (gapdH) gliseraldehida 3-fosfat (gapdH) gliseraldehida 3-fosfat 3.
Enzim mengkatalisasi oksidasi karbon C1 dari molekul menjadi asam karboksilat dan fosforilasi ini dalam posisi yang sama, menghasilkan 1,3-bifoscicerate. Dalam perjalanan reaksi, 2 molekul NAD+ dikurangi per molekul glukosa dan 2 molekul fosfat anorganik digunakan.
Dapat melayani Anda: trakea2GlyCerhyde 3-fosfat + 2nad + + 2pi → 2 (1,3-bifosphoglicatato) + 2nadh + 2h
Dalam organisme aerobik, masing -masing NADH diproduksi dengan cara ini melewati rantai konveyor elektron untuk berfungsi sebagai substrat untuk sintesis 6 molekul ATP karena fosforilasi oksidatif.
7- Ini adalah langkah pertama sintesis ATP dalam glikolisis dan menyiratkan aksi kinase fosfogliserato (PGK) pada 1,3-bifosfogliserat, mentransfer gugus fosforil (fosforilasi pada tingkat substrat) dari molekul ini ke molekul ADP, hasil 2ATP 2Atp dan 2 molekul 3-fosfoglikerat (3pg) untuk setiap molekul glukosa.
2 (1,3-bifosphoglicatato) + 2Adp → 2 (3-fosfogliserkir) + 2Atp
8- 3-fosfogliserat berfungsi sebagai substrat untuk enzim fosfogliserato mutasa (PGM), yang membuatnya 2-fosfoglikerat dengan perpindahan kelompok karbon 3 ke karbon 2 dengan menggunakan reaksi dua langkah yang dapat dibalik dan tergantung pada karbon 3 dengan menggunakan reaksi dua langkah yang dapat dibalik dan tergantung pada karbon 3 dengan menggunakan reaksi dua langkah yang dapat dibalik dan tergantung pada 3 Ion magnesium (mg+2).
2 (3-fosfoglikan) → 2 (2-fosfoglikan)
9- Enzim dalam dehidrat 2-fosfogliserat dan menghasilkan fosfoenoliruvat (PEP) dengan menggunakan reaksi yang tidak pantas untuk penambahan energi tambahan dan yang bertujuan untuk menghasilkan senyawa energi tinggi, yang mampu menyumbangkan kelompok fosforlnya dalam reaksi berikutnya.
2 (2-fosfoglikan) → 2foenolpiruvate
10- phosphoenolpiruvate adalah substrat enzim piruvat kinase (PYK), yang bertanggung jawab untuk transfer gugus fosforil dalam molekul ini terhadap molekul ADP, sehingga mengkatalisasi, oleh karena itu, reaksi lain dari fosforilasi pada tingkat substrat, oleh karena itu, reaksi fosforilasi lain pada tingkat substrat, oleh karena itu, fosforilasi pada tingkat substrat, oleh sehingga substrat,.
Dalam reaksi 2ATP dan 2 molekul piruvat diproduksi untuk setiap glukosa dan adanya kalium dan magnesium dalam bentuk ionik diperlukan.
2Fospo Elplivato + 2Adp → 2pyruvate + 2Atp
Kinerja bersih glikolisis, dengan cara ini, terdiri dari 2ATP dan 2NAD+ untuk setiap molekul glukosa yang memasuki rute.
Jika ini adalah sel dengan metabolisme aerobik, maka degradasi total molekul glukosa menghasilkan antara 30 dan 32 ATP melalui siklus Krebs dan rantai transportasi elektron.
Produk glikolisis
Reaksi umum glikolisis adalah sebagai berikut:
Glukosa + 2nad + + 2Adp + 2pi → 2pyruvate + 2atp + 2nadh + 2h+
Oleh karena itu, jika dianalisis secara singkat, itu dapat memastikan bahwa produk utama dari rute glikolitik adalah piruvat, ATP, NADH dan H.
Namun, tujuan metabolisme setiap perantara reaksi tergantung, sebagian besar, pada kebutuhan seluler, itulah sebabnya semua perantara dapat dianggap sebagai produk reaksi, mampu mencetaknya sebagai berikut:
- Glukosa 6-fosfat
- Fruktosa 6-fosfat
- Fruktosa 1,6-bifosfat
- Dihydroxyacetone fosfat dan gliseraldehida 3-fosfat
- 1.3-bifosphoglicerato
- 3-fosfogliserat dan 2-fosfogliserat
- Fosfoenolpiruvat dan piruvat
Pentingnya
Meskipun glikolisis, dengan sendirinya (dapat berbicara tentang glikolisis anaerob) hanya menghasilkan sekitar 5% dari ATP yang dapat diekstraksi dari katabolisme aerobik glukosa, rute metabolisme ini mendasar karena beberapa alasan:
- Ini berfungsi sebagai sumber energi "cepat", terutama dalam situasi di mana hewan harus meninggalkan keadaan istirahat dengan cepat, di mana proses oksidasi aerob tidak akan cukup cepat.
- Serat otot "putih" kerangka dalam tubuh manusia, misalnya, adalah serat kontraksi yang cepat dan bergantung pada glikolisis anaerob untuk berfungsi.
- Kapan, untuk beberapa alasan, sel membutuhkan glikolitik.
- Banyak sel bergantung pada glukosa sebagai sumber energi dengan rute glikolitik, termasuk sel darah merah, tidak memiliki organel internal, dan sel mata (terutama dari kornea) yang tidak memiliki kepadatan mitokondria yang hebat.
Referensi
- Canback, b., Andersson, s. G. DAN., & Kurland, C. G. (2002). Filogeni global enzim glikolitik. Prosiding National Academy of Sciences, 99 (9), 6097-6102.
- Chaudhry R, Varacallo M. Biokimia, glikolisis. [Diperbarui 2019 AP 21]. Dalam: Statpearls [Internet]. Treasure Island (FL): Statpearls Publishing; 2020 Jan-. Tersedia dari: https: // www.NCBI.Nlm.Nih.GOV/BUKU/NBK482303/
- Fothergill-Gilmore, l. KE., & Michels, P. KE. (1993). Evolusi glikolisis. Kemajuan dalam Biofisika dan Biologi Molekuler, 59 (2), 105-235.
- Kim, J. W., & Dang, c. V. (2005). Peran multifaset dari enzim glikolitik. Tren Ilmu Biokimia, 30 (3), 142-150.
- Kumari, a. (2017). Biokimia Manis: Mengingat Struktur, Siklus, dan Jalur oleh Mnemonics. Pers Akademik.
- Li, x. B., Gu, J. D., & Zhou, Q. H. (2015). Ulasan glikolisis aerobik dan target enzim kuncinya untuk terapi kanker paru-paru. Kanker toraks, 6 (1), 17-24.
- « Karakteristik, tipe, jenis hewan herbivora
- Karakteristik virus mosaik tembakau, struktur, replikasi »

