Hidrolisis apa yang terdiri dan contoh reaksi
- 4921
- 697
- Leland Robel
Itu hidrolisis Ini adalah reaksi kimia yang dapat terjadi pada molekul atau ion anorganik dan organik, dan yang melibatkan partisipasi air untuk pemecahan ikatannya. Namanya berasal dari bahasa Yunani, 'hidro' air, dan 'lisis' pecah.
Molekul air, h2Atau, itu menetapkan keseimbangan dengan ion garam asam dan basa lemah, muncul untuk pertama kalinya konsep ini dalam studi umum kimia dan dalam kimia analitik. Oleh karena itu adalah salah satu reaksi kimia paling sederhana.
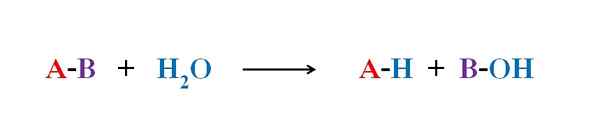 Persamaan Umum untuk Reaksi Hidrolisis. Sumber: Gabriel Bolívar.
Persamaan Umum untuk Reaksi Hidrolisis. Sumber: Gabriel Bolívar. Dalam beberapa contoh hidrolisis, air saja tidak dapat mematahkan ikatan kovalen tertentu. Ketika ini terjadi, proses mempercepat atau mengkatalisasi dengan pengasaman atau alkalisasi media; yaitu, di hadapan ion H3SALAH SATU+ Atau oh-, masing -masing. Ada juga enzim yang mengkatalisasi hidrolisis.
Hidrolisis menempati tempat khusus dalam hal biomolekul, karena tautan yang membuat monomer mereka tetap rentan terhadap hidrolisis dalam kondisi tertentu. Misalnya, gula dihidrolisis untuk menguraikan polisakarida di konstituennya monosakarida berkat aksi enzim glukosidase.
[TOC]
Apa itu hidrolisis?
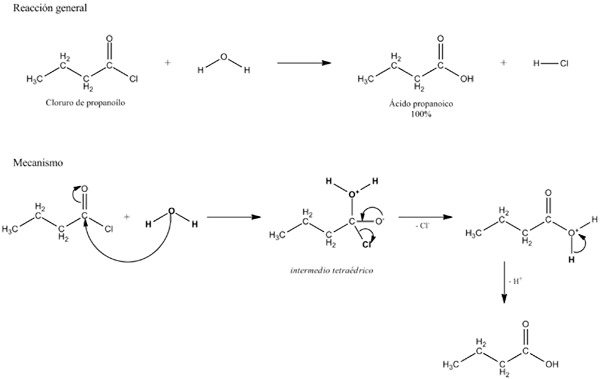
Gambar atas menjelaskan apa yang terdiri dari hidrolisis. Perhatikan bahwa tidak hanya molekul atau substrat (jika mereka memediasi enzim) memecah tautannya, tetapi juga air itu sendiri, yang merupakan "fraktur" di H+ dan oh-, Dimana h+ diakhiri dengan A, dan oh- dengan b. A-B bereaksi dengan molekul air yang berasal dari dua produk, A-H dan B-OH.
Oleh karena itu, hidrolisis adalah reaksi yang bertentangan dengan kondensasi. Dalam kondensasi dua produk, untuk mengatakan A-H dan B-OH, diikat dengan pelepasan molekul kecil: air. Dalam hidrolisis sebuah molekul dikonsumsi, sedangkan dalam kondensasi dilepaskan atau diproduksi.
Ini dapat melayani Anda: Grup Karbonil: Karakteristik, Properti, Nomenklatur, ReaktivitasKembali ke contoh gula, anggaplah bahwa A-B sesuai dengan dimer sukrosa, di mana ia mewakili glukosa, dan B fruktosa. A-B, Link Glucosidic dapat dihidrolisaris untuk berasal dari dua monosakarida secara terpisah dan dalam larutan, dan hal yang sama terjadi pada oligo dan polisakarida jika mereka memediasi enzim dalam reaksi tersebut.
Perhatikan bahwa dalam reaksi ini, bahwa A-B, panah hanya memiliki satu alamat; Artinya, ini adalah hidrolisis yang tidak dapat diubah. Namun, banyak hidrolisis sebenarnya adalah reaksi reversibel yang mencapai keseimbangan.
Contoh reaksi hidrolisis
- ATP
ATP stabil antara nilai pH 6,8 dan 7.4. Namun, pada nilai pH ekstrem itu dihidrolisis secara spontan. Pada makhluk hidup, hidrolisis dikatalisis oleh enzim yang dikenal sebagai Atasas:
ATP +H2O => ADP +PI
Reaksi ini sangat eksergonik, karena entropi ADP lebih besar dari ATP. Variasi energi bebas Gibbs (ΔGº) adalah - 30,5 kJ/mol. Energi yang dihasilkan oleh hidrolisis ATP digunakan dalam berbagai reaksi endergon.
Reaksi digabungkan
Dalam beberapa kasus, hidrolisis ATP digunakan untuk konversi senyawa dalam suatu senyawa (b).
A +ATP +H2Atau b +adp +pi +h+
- Air
Dua molekul air dapat bereaksi satu sama lain dalam hidrolisis yang jelas:
H2Atau + h2Atau h3SALAH SATU+ + Oh-
Seolah -olah salah satu molekul air yang retak dalam H+ dan oh-, akan menautkan h+ Ke atom oksigen dari molekul air lainnya, yang menyebabkan ion hidrium, h3SALAH SATU+. Reaksi ini, lebih dari hidrolisis, adalah tentang propotolisis air sendiri.
Dapat melayani Anda: energi aktivasi- Protein
Protein adalah makromolekul yang stabil dan untuk mencapai hidrolisis lengkapnya, dalam asam amino yang membentuknya, kondisi ekstrem diperlukan; seperti konsentrasi asam klorida (6 m) dan suhu tinggi.
Namun, makhluk hidup diberkahi dengan arsenal enzimatik yang memungkinkan hidrolisis protein dalam asam amino dalam duodenum. Enzim yang terlibat dalam pencernaan protein hampir sepenuhnya disekresikan oleh pankreas.
Ada enzim exopeptidase yang mendegradasi protein, mulai dari ujungnya: aminopeptidase melalui ujung amino, dan carboxypeptidase melalui ujung karboksil. Enzim endopeptidase mengerahkan aksinya di dalam rantai protein, misalnya: tripsin, pepsin, chimotripsin, dll.
- Amidas dan ester
Amida saat dipanaskan dalam media alkali berasal dari asam karboksilat dan amina:
Rconh2 + H2O => rcoo- + NH2
Abeats dalam media berair dihidrolisis dalam asam karboksilat dan alkohol. Prosesnya dikatalisasi baik oleh basa atau asam:
Rco-or ' +h2O => rcooh +r'oh
Ini adalah reaksi saponifikasi yang terkenal.
- Asam basa
Di dalam air beberapa spesies dihidrolisis untuk mengasamkan atau alkalisasi lingkungan berair.
Penambahan garam dasar
Natrium asetat, garam dasar, disosiasi dalam air yang memberikan ion na+ (Sodium) dan Cho3Mendekut- (asetat). Basisitasnya adalah karena asetat dihidrolisis untuk menghasilkan ion oh-, Sementara natrium tetap tidak berubah:
Ch3Mendekut- + H2Atau ch3COOH +OH-
Itu bisa melayani Anda: metil salisilatOH- Dia bertanggung jawab atas pH untuk meningkat dan menjadi mendasar.
Penambahan garam asam
Amonium klorida (NH4Cl) dibentuk oleh ion klorida (CL-) dari asam klorida (HCl), asam kuat, dan kation amonium (NH4+) dari amonium hidroksida (NH4Oh), dasar yang lemah. Cl- Itu tidak terdisosiasi dalam air, tetapi kation amonium diubah menjadi air dengan cara berikut:
NH4+ + H2Atau nh3 + H3SALAH SATU+
Hidrolisis kation amonium menghasilkan proton yang meningkatkan keasaman media berair, sehingga disimpulkan bahwa NH4CL adalah garam asam.
Penambahan garam netral
Sodium klorida (NaCl) adalah produk garam dari reaksi basa yang kuat (NaOH) dengan asam kuat (HCl). Saat melarutkan natrium klorida dalam air, kation natrium diproduksi (NA+) dan anion (cl-). Kedua ion tidak terpisah di dalam air, sehingga mereka tidak menambahkan h+ Atau oh-, Menjaga pH konstan Anda.
Oleh karena itu, dikatakan bahwa natrium klorida adalah garam netral.
Referensi
- Mathews, c. K., Van Holde, K. DAN. Dan Ahern, k. G. (2002). Biokimia. (Edisi ketiga). Edit. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Helmestine, Anne Marie, PH.D. (13 Januari 2019). Hidrolisis: Definisi dan contohnya. Pulih dari: thinkco.com
- Theresa Phillips. (28 April 2019). Penjelasan tentang proses hidrolisis. Pulih dari: keseimbangan.com
- Para editor Eeritlopaedia Britannica. (16 November 2016). Hidrolisis. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Wikipedia. (2019). Hidrolisis. Diperoleh dari: di.Wikipedia.org
- « Karakteristik Hyracotherium, Nutrisi, Spesies, Reproduksi
- History of Origins Video Game untuk Realitas Virtual »

