Hidrokarbon tak jenuh
- 4089
- 425
- Leland Robel
Kami menjelaskan apa hidrokarbon tak jenuh, klasifikasi, sifatnya, nomenklatur dan memberikan beberapa contoh
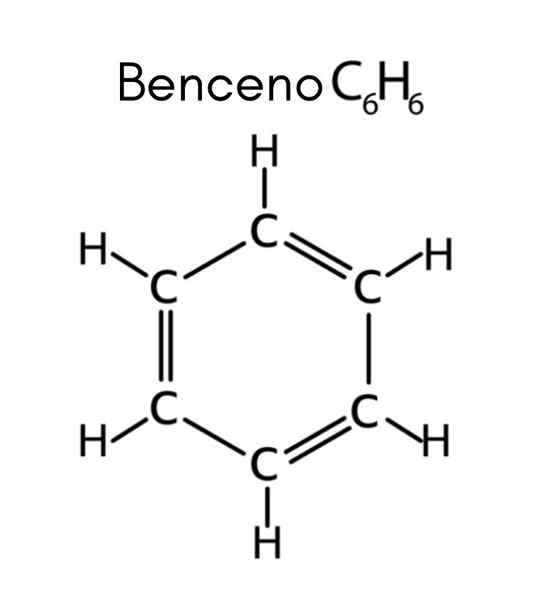
 Benzene adalah contoh hidrokarbon tak jenuh
Benzene adalah contoh hidrokarbon tak jenuh Apa itu hidrokarbon tak jenuh?
Itu Hidrokarbon tak jenuh Mereka adalah senyawa organik yang hanya dibentuk oleh karbon dan hidrogen, yang memiliki satu atau lebih banyak ikatan antara atom karbon. Ini berarti senyawa formula C apa punXHDan yang menghadirkan ikatan ganda atau tiga adalah hidrokarbon yang tidak jenuh.
Hidrokarbon tak jenuh dibentuk oleh alkena dan alkine, serta senyawa aromatik. Alasan mengapa mereka tidak jenuh adalah karena mereka memiliki jumlah hidrogen yang lebih kecil dari maksimum yang bisa mereka miliki, mengingat jumlah atom karbon dalam struktur.
Hidrokarbon tak jenuh diakui dengan memiliki kurang dari 2N+2 hidrogen (yang merupakan jumlah maksimum hidrogen yang dapat berupa karbon), di mana n adalah jumlah atom karbon dalam formula molekul.
Contoh hidrokarbon tak jenuh adalah buteno, yang formulanya molekulnya c4H8. Jumlah maksimum hidrogen untuk 4 karbon adalah 2 (4) +2 = 10 hidrogen. Ini sesuai dengan jumlah hidrogen hidrokarbon jenuh. Karena buteno hanya memiliki 8 hidrogen, yang kurang dari 10, maka itu adalah hidrokarbon tak jenuh.
Jumlah tidak jenuh
Hidrokarbon tak jenuh ditandai dengan jumlah tidak jenuh. Ini menunjukkan jumlah pasangan hidrogen kurang dari hidrokarbon tak jenuh dibandingkan dengan yang jenuh yang memiliki jumlah karbon yang sama.
Jumlah tidak jenuh dapat dihitung untuk senyawa tak jenuh apa pun dengan menggunakan rumus berikut:
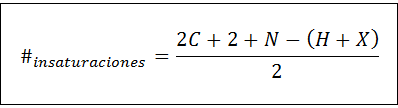
Di mana c, n, h dan x mewakili jumlah karbon, nitrogen, hidrogen dan halogen dalam formula molekul, masing -masing. Angka ini memberi kita gambaran tentang berapa banyak ikatan ganda atau tiga yang memiliki senyawa, mengingat formula molekulnya, meskipun perawatan harus diambil karena siklus (yang tidak jenuh) juga berkontribusi pada jumlah tidak jenuh:

Contoh
Benzena memiliki formula C6H6, Jadi jumlah tidak jenuhnya adalah:
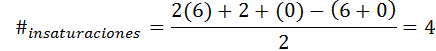
Dalam hal ini, 4 tidak jenuh sesuai dengan tiga tautan ganda dan siklus.
Klasifikasi hidrokarbon tak jenuh
Menurut jenis hidrokarbon
- Alkena: Mereka adalah mereka yang memiliki setidaknya satu tautan ganda dalam strukturnya.
- Alkynes: Mereka adalah mereka yang memiliki setidaknya satu link triple dalam struktur mereka.
- Aromatik: Mereka adalah senyawa tak jenuh ganda siklik dengan sifat khusus yang membuatnya sangat stabil.
Menurut rantai karbon
- Linear: senyawa tak jenuh di mana semua atom karbon saling terkait.
- Bercabang: Mereka adalah mereka yang memiliki rantai utama dan juga beberapa rantai lateral yang membentuk konsekuensi.
- Berhubung dgn putaran: Mereka adalah mereka di mana siklus tertutup atom karbon disajikan di mana setidaknya satu ikatan ganda atau tiga disajikan (sikloalquenos, sikloalquinos dan aromatik).
Menurut jumlah tidak jenuh
- Tak jenuh tunggal: Ketika mereka hanya memiliki banyak tautan, yaitu, itu adalah ikatan rangkap tunggal atau tautan triple tunggal.
- Polynstaturasi: Ketika struktur memiliki lebih dari satu tautan berganda, seperti dalam kasus Alkian, Alkian, Alkenin, dll.
Sifat hidrokarbon tak jenuh
Sifat -sifat hidrokarbon tak jenuh sangat bergantung pada jenis hidrokarbon tertentu yang dimaksud:
Fusion dan titik didih
Secara umum, hidrokarbon tak jenuh memiliki titik fusi dan didih rendah. Namun, dibandingkan dengan alkana, alkena dengan jumlah karbon yang sama dan rantai utama yang serupa biasanya memiliki titik didih yang lebih rendah, sedangkan alkine cenderung memiliki titik didih yang lebih besar.
Hal yang sama berlaku untuk poin fusi. Dalam tabel berikut dapat dilihat bahwa titik fusi dan perebusan 1-pentene lebih rendah daripada pentan dan ini yang dari 1-pentino.

Keadaan fisik
Karena titik leleh dan mendidihnya yang rendah, hidrokarbon dengan berat molekul rendah yang tidak jenuh cenderung gas pada suhu kamar. Banyak juga cair dan berat molekul yang lebih besar padat. Dalam banyak kasus, padatan adalah padatan amorf, bukan kristal.
Polaritas
Semua hidrokarbon, termasuk tak jenuh, adalah senyawa apolar, karena karbon elektronegativitas dan hidrogen sangat mirip. Satu -satunya pengecualian adalah dalam kasus alkine terminal2 dan sp3.
Kelarutan
Menjadi apolar, hidrokarbon tak jenuh tidak larut dalam air dan pelarut kutub lainnya, tetapi mereka sangat larut dalam pelarut apolar seperti karbon tetraklorida, sikloheksan dan lainnya. Faktanya, banyak dari senyawa ini, dalam diri mereka sendiri, pelarut apolar.
Itu dapat melayani Anda: Disposio: Struktur, Properti, Memperoleh, PenggunaanMereka adalah bahan bakar
Karakteristik semua hidrokarbon, termasuk tak jenuh, adalah bahwa mereka terbakar di hadapan oksigen menjadi karbon dioksida dan air melepaskan energi dalam bentuk cahaya dan panas.
Mereka dapat polimerisasi
Melalui reaksi kimia yang berbeda, alkena dan alkine dapat saling bergabung untuk membentuk polimer seperti dalam kasus polietilen dan polipropilena, hanya untuk menyebutkan beberapa. Begitu jenuh hidrokarbon adalah bahan awal dari banyak plastik umum.
Reaktivitas kimia
Reaktivitas sangat tergantung pada jenis kelompok fungsional yang memiliki molekul. Dalam kasus alkena dan alkine, ini biasanya cukup reaktif dan dapat menderita reaksi hidrogenasi, hidrasi, hidrohalogenasi dan jenis reaksi tambahan lainnya.
Di sisi lain, senyawa aromatik biasanya cukup lembam karena sangat stabil. Reaksi karakteristik dari senyawa ini adalah reaksi substitusi elektrofilik aromatik.
Nomenklatur hidrokarbon tak jenuh
Nomenklatur Alkena
Alkena linier
Nama alkena linier dibangun dengan menempatkan awalan yang menunjukkan jumlah atom karbon dalam rantai, diikuti oleh pencari karbon di mana ikatan rangkap yang terpisah dimulai dengan skrip dari sisa nama dan selesai dengan akhiran _eno:
PREFIX-LOCALIZER
- Contoh:
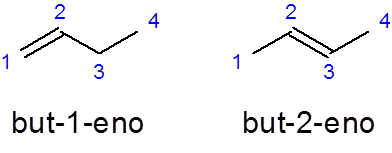
Dia But -1 -No Itu adalah nama butene linear dengan ikatan rangkap pada karbon pertama saat Tapi-2-sembilan Ini memiliki ikatan rangkap dalam karbon kedua.
Alkena bercabang
Dalam kasus alkena bercabang, rantai utama terpanjang yang mengandung kedua karbon ikatan rangkap pertama kali dipilih dan prioritas untuk ikatan rangkap diberi nomor. Namanya dibangun terlebih dahulu dengan menempatkan konsekuensi dalam urutan abjad yang didahului oleh locator -locatornya diikuti dengan nama rantai utama seperti yang ditunjukkan di atas.
- Contoh:
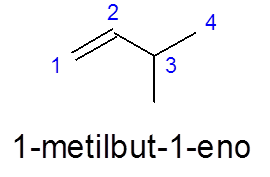
Dalam 3-methylbut-1 -en, penomoran dilakukan dari kiri ke kanan untuk memberikan prioritas pada ikatan rangkap, alih-alih memberikan prioritas untuk bercabang (kelompok metil).
Polienes
Dalam kasus alkena tak jenuh ganda atau polien, yang mengandung lebih dari satu ikatan rangkap, jumlah terbesar dari ikatan rangkap dipilih sebagai rantai utama, terlepas dari apakah ada rantai lain yang lebih panjang lainnya.
Atas nama rantai utama, seorang locator ditambahkan untuk setiap ikatan rangkap dan awalan di, tri, tetra, dll. Sebelum penghentian -eno, untuk menunjukkan jumlah tautan ganda yang Anda miliki.
- Contoh:
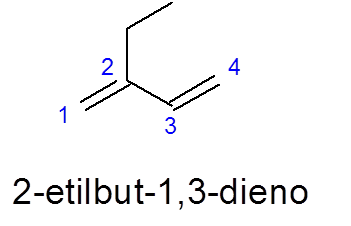
Catatan dalam hal ini bahwa terlepas dari kenyataan bahwa ada rantai 5 -karbon yang lebih lama, 4 dari 4 dipilih, karena berisi dua tautan ganda.
Nomenklatur Alquinos
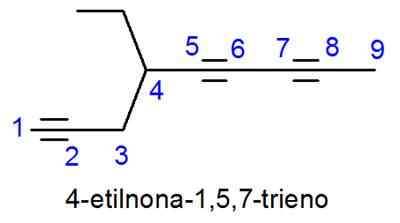
Alkynes dinamai sangat mirip dengan alkena, dengan satu -satunya perbedaan bahwa namanya berakhir di -ino, bukan -eno. Dalam kasus di mana ada lebih dari satu link triple, pelacak semuanya ditempatkan dan awalan numerik yang menunjukkan berapa banyak yang ada.
- Contoh:
Nomenklatur senyawa aromatik
Hidrokarbon aromatik ditunjuk sebagai turunan benzena dan baik penomoran dan cara menamai mereka tergantung pada berapa banyak substituen yang dimiliki cincin tersebut.
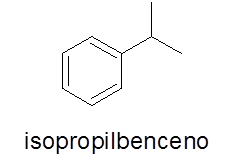
Cincin aromatik dengan substituen tunggal
Dalam hal ini tidak perlu. Namanya terdiri dari nama cabang diikuti oleh kata benzena.
- Contoh:
Cincin aromatik dengan dua substituen
Dalam hal ini, 3 angka atau pola penggantian dapat diberikan (1.2), (1.3) dan (1,4). Karena acuh tak acuh untuk menunjukkan pengganti mana yang ada dalam karbon 1 dan yang lainnya, orto awalan (O-), meta- (m-) dan para- (p-), masing-masing, untuk merujuk pada hal yang sama.
- Contoh:
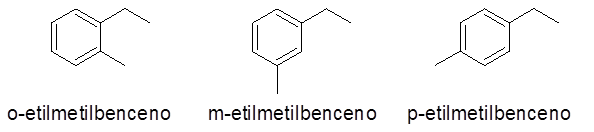
Cincin aromatik dengan lebih dari 2 substituen
Dalam hal ini, penomoran kombinasi terkecil dari locator dipilih. Jika dua angka sama, prioritas diberikan untuk substituen sesuai dengan urutan abjad.
- Contoh:
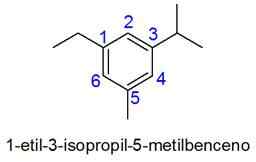
Contoh hidrokarbon tak jenuh
Selanjutnya, contoh tambahan hidrokarbon tak jenuh disajikan kepada yang telah disebutkan.
Asetilena (c2H2)
Asetilena adalah nama umum dari Etino, alkimin paling sederhana. Senyawa ini memiliki 2 tidak jenuh karena triple link dan digunakan, antara lain, dalam peralatan baja dan pengelasan.
Cyclohexen (c6H10)
6 -karbon siklik alkena yang memiliki dua tidak jenuh: satu karena siklus dan yang lainnya karena ikatan rangkap.
Peregangan (c8H8)
Senyawa ini umumnya digunakan dalam persiapan polimer. Itu adalah alkena aromatik dengan 5 tidak jenuh.

