Struktur aluminium hidrida (ALH3), sifat, penggunaan
- 1045
- 70
- Tommie Smith
Dia Aluminium hidrida Itu adalah senyawa anorganik yang formula kimianya adalah alh3. Meskipun tampaknya bersifat sederhana, itu sebenarnya zat yang agak rumit. Karena kecerahan kristal yang dapat terjadi pada padatannya, biasanya dianggap sebagai hidrida ionik, yang dibentuk oleh ion ke dalam3+ dan H-.
Namun, sifat -sifatnya menunjukkan sebaliknya: itu adalah padatan polimer, yang representasi yang paling setia akan menjadi tipe (ALH3)N, makhluk N Jumlah unit monomerik3 Itu akan mengintegrasikan rantai atau lapisan kaca. Oleh karena itu, alh3 Ini adalah salah satu polimer yang berhasil mengadopsi struktur kristal.
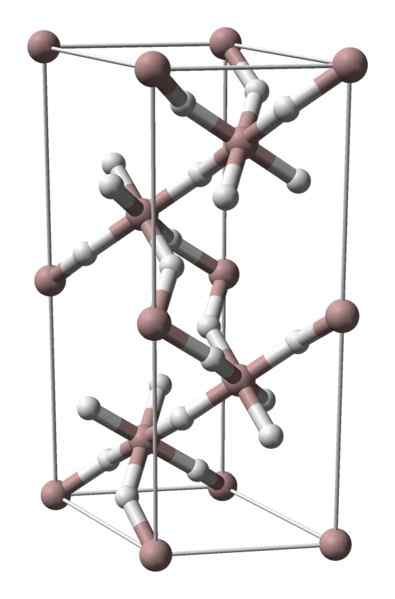 Struktur kristal aluminium hidrida. Sumber: Benjah-BMM27 / Domain Publik
Struktur kristal aluminium hidrida. Sumber: Benjah-BMM27 / Domain Publik Aluminium hidrida tidak padat dengan banyak difusi komersial, jadi gambar yang tersedia langka. Ini terutama digunakan untuk sintesis organik, di mana ia berfungsi sebagai agen pereduksi yang kuat. Ini juga menempati tempat khusus dalam kemajuan teknologi bahan, menjadi alternatif yang menjanjikan untuk penyimpanan hidrogen.
Senyawa ini, juga disebut Alano, menjaga hubungan dekat dengan Lialh4, yang namanya adalah aluminium dan lithium hidrida, lithium alanate, atau lithium tetrahydroalumination. Meskipun memiliki karakteristik polimer dan metastabilitas termal, itu terjadi pada tujuh polimorf dengan morfologi kristal yang berbeda.
[TOC]
Struktur
Koordinasi
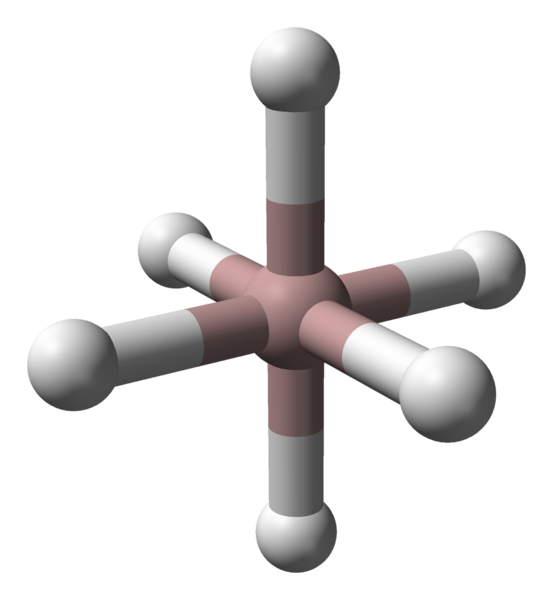
 Koordinasi oktahedral kation aluminium dalam kristal ALH3. Sumber: Benjah-BMM27 / Domain Publik.
Koordinasi oktahedral kation aluminium dalam kristal ALH3. Sumber: Benjah-BMM27 / Domain Publik. Terlepas dari polimorf atau fase kristal yang dipertimbangkan, koordinasi antara aluminium dan atom hidrogen konstan. Pada gambar atas, misalnya, seperti pada gambar pertama, koordinasi octahedron untuk atom aluminium (bola coklat) ditampilkan pada gambar pertama.
Dapat melayani Anda: hukum stoikiometriSetiap atom dikelilingi oleh enam jam, membangun enam tautan AL-H. Cara di mana Octahedra berorientasi di ruang angkasa akan membuat perbedaan struktural antara satu polimorf dan lainnya.
Di sisi lain, masing-masing atom H dikoordinasikan dengan dua atom AL, membangun ikatan AL-H-Al, yang dapat dibenarkan dengan tautan tipe 3C2E (elektron 3 pusat-2). Tautan ini bertanggung jawab untuk bergabung dengan beberapa octaedros alh6 di seluruh kristal Alano.
Molekul terisolasi
Alh3 Itu dianggap polimer karena jaringan ALH6 yang mengintegrasikan kaca. Untuk mengisolasi molekul Alano individu, perlu menerapkan tekanan rendah di atmosfer gas mulia yang lembam. Dengan cara ini, polimer pecah dan melepaskan molekul ALH3 geometri datar trigonal (analog dengan BH3).
Di sisi lain, dimungkinkan untuk mengurangi dua alh3 untuk membentuk a2H6, Seperti halnya diborano, b2H6. Namun, untuk mencapai ini, penggunaan hidrogen padat diperlukan, jadi mungkin tidak memiliki banyak nilai jangka panjang industri atau komersial.
Polimorf
Alano atau Alh3 Ini mampu membentuk hingga tujuh polimorf: α, α ', β, γ, δ, ε dan ζ, di mana α adalah perubahan suhu yang paling stabil. Α-alh3 Ini dibedakan dengan memiliki morfologi kubik dan struktur kristal heksagonal. Itu cenderung menjadi produk di mana polimorf lain diubah ketika mereka menderita destabilisasi termal.
Morfologi γ-alh3, Di sisi lain, itu menonjol karena tipe jarum. Itulah sebabnya alh3 Padatan dapat mengandung campuran lebih dari dua polimorf, dan menyajikan berbagai kristal ke mikroskop.
Properti
Penampilan fisik
Aluminium hidrida adalah penampilan kristal padat atau keputihan yang tidak berwarna atau keputihan dengan kecenderungan untuk menunjukkan bentuk jarum.
Dapat melayani Anda: asam sulfonat: struktur, nomenklatur, sifat, penggunaanMasa molar
29.99 g/mol O 30 g/mol
Titik lebur
150 ºC. Tapi mulai pecah dari 105 ° C.
Kelarutan air
Tinggi, lalu bereaksi dengannya.
Kelarutan
Tidak larut dalam pelarut dietil dan apolar seperti benzena dan pentan. Bereaksi dengan alkohol dan pelarut kutub lainnya.
Penguraian
Alh3 Rentan untuk membusuk pada kecepatan yang berbeda tergantung pada kondisi eksternal, morfologi dan stabilitas termal kristal mereka, atau penggunaan katalis. Ketika itu terjadi, ia melepaskan hidrogen dan berubah menjadi aluminium logam:
2alh3 → 2al + 3H2
Faktanya, dekomposisi ini daripada menjadi masalah, merupakan salah satu alasan mengapa Alano dianggap menarik dalam pengembangan teknologi energi baru.
Pembentukan adduct
Saat alh3 Itu tidak bereaksi dengan pelarut secara ireversibel, itu membuat adduct dengannya, yaitu, jenis kompleks. Misalnya, Anda dapat membentuk kompleks dengan trimethylamine, ALH3· 2n (cho3)3, Dengan Tetrahydrofurano, ALH3· THF, atau dengan diet, ALH3· Et2SALAH SATU. Yang terakhir adalah yang paling dikenal ketika sintesis atau mendapatkan alano diperkenalkan pada tahun 1947.
Memperoleh
Penampilan pertama alh3 Mereka berasal dari tahun 1942 dan 1947, karena ini tahun lalu ketika sintesisnya disajikan menggunakan Lialh4 Dalam medium dietil:
3lialh4 + Alcl3+ NEt2O → 4alh3 · NEt2O + 3licl
Solusi halus, alh3 · NEt2Atau, dia harus tunduk untuk mengecewakan, dengan tujuan menghilangkan ET2Atau dan dapatkan alh3 murni. Selain masalah ini, LICL harus dihilangkan dari media produk.
Dengan demikian, dari tahun 1950 hingga 1977, sintesis baru dirancang untuk mendapatkan hasil ALH yang lebih baik3, serta padatan paling murni dan sifat termal dan morfologis yang lebih baik. Memodifikasi jumlah, langkah, dan instrumen yang digunakan, dimungkinkan untuk mendukung mendapatkan polimorf di atas yang lain. Namun, α-alh3 Biasanya produk mayoritas.
Itu dapat melayani Anda: Alilo: Unit Allyic, Carbocation, Radikal, ContohMetode sintesis lainnya terdiri dari memanfaatkan elektrokimia. Untuk melakukan ini, anoda aluminium dan katoda platinum digunakan. Dalam anoda reaksi berikut berlalu:
3alh4- + Ke3+ + NTHF → 4Alh3 · NTHF + 3E-
Saat berada di dalam katoda, natrium logam diperoleh. Lalu alh3 · NTHF juga mengalami kecewa untuk menghilangkan THF dan akhirnya mendapatkan ALH3.
Aplikasi
Agen pereduksi
Alh3 Ini berfungsi untuk mengurangi kelompok fungsional tertentu dari senyawa organik seperti asam karboksilat, keton, aldehida dan ester. Secara praktis, apa yang dilakukannya adalah menambahkan hidrogen. Misalnya, ster dapat dikurangi menjadi alkohol di hadapan kelompok nitro:
 Pengurangan ster dengan aluminium hidrida. Sumber: Jahe / Domain Publik.
Pengurangan ster dengan aluminium hidrida. Sumber: Jahe / Domain Publik. Reservoir hidrogen
Aluminium hydride merupakan alternatif untuk berfungsi sebagai reservoir hidrogen, dan dengan demikian, untuk dapat mengeluarkannya secara terputus di perangkat yang beroperasi dengan baterai hidrogen. Volume yang diperoleh dari h2 sesuai dengan volume ganda yang lebih besar dari ALH3.
Memiliki alh3, dan membusuknya dikendalikan, sejumlah h yang diinginkan dapat dilepaskan2 kapan pun. Oleh karena itu, dapat digunakan sebagai bahan bakar roket dan semua aplikasi energi yang berupaya memanfaatkan pembakaran hidrogen.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (edisi keempat). MC Graw Hill.
- Wikipedia. (2020). Hydride aluminium. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi. (2020). Hydride aluminium. Database pubchem., CID = 14488. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- J. Graetz et al. (2011). Aluminium hidrida sebagai bahan penyimpanan hidrogen dan energi: masa lalu, sekarang dan masa depan. Elsevier b.V.
- Xu Bo et al. (2014). Persiapan dan sifat termal polimorf hidrida siswa. doi.org/10.1016/j.Kekosongan.2013.05.009
- « Konsep variasi linier, contoh, latihan diselesaikan
- Bentuk bumi dan konsekuensi fisik dan astronominya »

