Struktur aluminium hidroksida, sifat, penggunaan, risiko
- 2749
- 808
- Leland Robel
Dia Aluminium hidroksida Ini adalah senyawa anorganik yang formula kimianya ada di (OH)3. Tidak seperti hidroksida logam lainnya, itu adalah amfotero satu, mampu bereaksi atau berperilaku seperti asam atau basa, tergantung pada medium. Ini adalah padatan putih yang cukup tidak larut dalam air, jadi ia menemukan penggunaan sebagai komponen antasida.
Seperti MG (oh)2 atau Brucita, yang dengannya ia berbagi karakteristik kimia dan fisik tertentu, murni terlihat seperti amorf dan bersinar padat; Tetapi saat mengkristal dengan beberapa kotoran memperoleh bentuk kristal seolah -olah mereka adalah mutiara. Di antara mineral ini, sumber alami AL (OH)3, adalah gibbsita.
 Kristal Gibbsita Khusus. Sumber: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Kristal Gibbsita Khusus. Sumber: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Selain gibbsite juga mineral Bayerite, Nordstrandite dan Doleyíta, membentuk empat polimorf aluminium hidroksida. Secara struktural mereka sangat mirip satu sama lain, saling membedakan dalam cara bagaimana lapisan atau lembaran ion berada atau digabungkan, serta jenis kotoran yang terkandung.
Mengontrol pH dan parameter sintesis, salah satu polimorf ini dapat disiapkan. Demikian juga, beberapa spesies kimia yang menarik dapat diselingi di antara lapisannya, sehingga bahan atau senyawa diseling. Ini mewakili penggunaan lebih banyak pendekatan teknologi untuk AL (OH)3. Penggunaan lainnya seperti antasida.
Di sisi lain, digunakan sebagai bahan baku untuk mendapatkan alumina, dan nanopartikelnya telah digunakan sebagai dukungan katalitik.
[TOC]
Struktur
Formula dan Octaedro
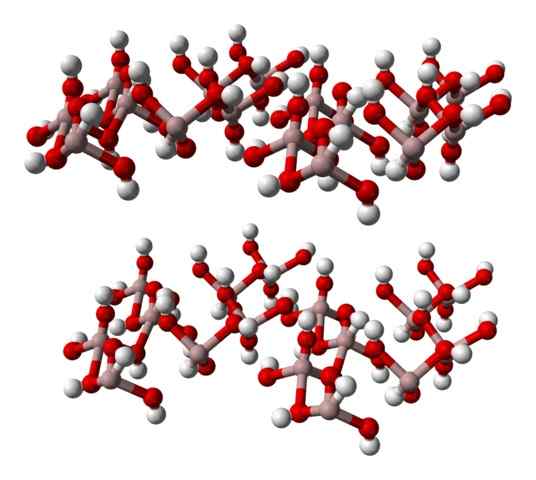
Formula kimia di (OH)3 menunjukkan begitu hubungannya3+: Oh- Ini 1: 3; yaitu, ada tiga anion oh- untuk setiap kation3+, yang sama dengan mengatakan bahwa bagian ketiga dari ionnya sesuai dengan aluminium. Jadi, AL3+ dan oh- Mereka berinteraksi secara elektrostatik sampai re-re-repulsions mereka menentukan kristal heksagonal.
Namun, al3+ Itu tidak harus dikelilingi oleh tiga oh- tetapi enam; Oleh karena itu, ada pembicaraan tentang koordinasi octahedron, di (OH)6, di mana ada enam interaksi al-o. Setiap octahedron mewakili unit dengan mana kaca dibangun, dan beberapa dari mereka mengadopsi struktur triklinik atau monoklinik.
Gambar bawah sebagian mewakili octahedra ke (OH)6, karena hanya empat interaksi yang diamati3+ (Bola coklat muda).
 Kaca heksagonal gibbsite, mineral aluminium hidroksida. Sumber: Benjah-BMM27 [Domain Publik].
Kaca heksagonal gibbsite, mineral aluminium hidroksida. Sumber: Benjah-BMM27 [Domain Publik]. Jika struktur ini diamati dengan hati -hati, yang sesuai dengan mineral Gibbsite, dapat direnungkan bahwa bola putih mengintegrasikan "wajah" atau permukaan lapisan ion; Ini adalah, atom hidrogen ion OH-.
Dapat melayani Anda: sewa halogenuros: properti, mendapatkan, contohPerhatikan bahwa ada lapisan A dan B lainnya (secara spasial tidak identik), bersama satu sama lain dengan jembatan hidrogen.
Polimorf
Lapisan A dan B tidak selalu digabungkan dengan cara yang sama, serta lingkungan fisik atau ion tamu mereka (garam) dapat berubah. Akibatnya, kristal Al (OH)3 Mereka bervariasi dalam empat bentuk mineralogi atau, dalam hal ini, polimorfik.
Kemudian dikatakan bahwa aluminium hidroksida memiliki hingga empat polimorf: gibbsite atau hidragilit (monoklinik), bayerit (monoklinik), doyleíta (tricycling) dan nordstrandite (trichlinic). Dari polimorf ini, gibbsita adalah yang paling stabil dan berlimpah; Yang lain diklasifikasikan sebagai mineral langka.
Jika kristal diamati pada mikroskop, akan terlihat bahwa geometri mereka heksagonal (meskipun agak tidak teratur). PH memainkan peran penting dalam pertumbuhan kristal tersebut dan struktur yang dihasilkan; yaitu, diberi pH polimorf atau lainnya dapat terbentuk.
Misalnya, jika media di mana AL (OH) endapan3 Ini memiliki pH kurang dari 5,8 gibbsita terbentuk; Sementara jika pH lebih besar dari nilai ini, bayerita terbentuk.
Di media yang lebih mendasar, kristal Nordstrandita dan Doyleíta cenderung terbentuk. Dengan demikian, menjadi Gibbsite yang paling berlimpah, itu adalah fakta yang mencerminkan keasaman lingkungan pelapunya.
Properti
Penampilan fisik
Padatan putih yang dapat datang dalam format yang berbeda: granulasi atau bubuk, dan penampilan amorf.
Masa molar
78.00 g/mol
Kepadatan
2.42 g/ml
Titik lebur
300 ° C. Tidak ada titik mendidih karena hidroksida kehilangan air untuk berubah menjadi alumina atau aluminium oksida, menjadi2SALAH SATU3.
Kelarutan air
1 · 10-4 G/100 ml. Namun, kelarutannya meningkat dengan penambahan asam (h3SALAH SATU+) atau alkalis (oh-).
Produk kelarutan
Ksp = 3 · 10−34
Nilai kecil ini berarti bahwa hanya sebagian kecil yang larut dalam air:
Al (oh)3(garam3+(AC) +3OH-(AC)
Dan pada kenyataannya kelarutan tercela ini menjadikannya penetral keasaman yang baik, karena tidak mendasarkan lingkungan lambung terlalu banyak untuk tidak melepaskan hampir ion oh-.
Anfoterisme
AL (OH)3 Ini ditandai dengan karakter amfoternya; yaitu, dapat bereaksi atau berperilaku seolah -olah itu adalah asam atau basa.
Misalnya, bereaksi dengan ion H3SALAH SATU+ (Jika mediumnya berair) untuk membentuk acuo kompleks [ke (oh2)6]3+; yang pada gilirannya dihidrolisis untuk mengasamkan lingkungan, oleh karena itu AL3+ Ion asam:
Dapat melayani Anda: Reaksi Cannizzaro: Karakteristik, Mekanisme, ContohAl (oh)3(S) +3H3SALAH SATU+(ac) => [al (oh2)6]3+(AC)
[Al (oh2)6]3+(Ac) +h2Atau (l) [al (oh2)5(Oh)]2+(Ac)+h3SALAH SATU+(AC)
Ketika ini terjadi, dikatakan bahwa al (oh)3 Itu berperilaku seperti basis, karena bereaksi dengan h3SALAH SATU+. Di sisi lain, Anda dapat bereaksi dengan oh-, berperilaku seperti asam:
Al (oh)3(s) +oh-(ac) => ah (oh)4-(AC)
Dalam reaksi ini endapan putih Al (OH)3 Itu larut ke kelebihan ion oh-; Fakta itu tidak terjadi sama dengan hidroksida lain, seperti magnesium, mg (oh)2.
AL (OH)4-, ion aluminasi, dapat diekspresikan lebih tepat sebagai: [al (oh2)2(OH)4]-, menyoroti jumlah koordinasi 6 untuk kation3+ (Octaedro).
Ion ini dapat terus bereaksi dengan lebih banyak oh- Sampai koordinasi octahedron: [al (oh)6]3-, disebut ion hexahidroxoaluminate.
Tata nama
Nama 'Aluminium Hydroxide', yang paling merujuk pada senyawa ini, sesuai dengan yang diperintah oleh nomenklatur stok. (Iii) dihilangkan di ujungnya, karena status oksidasi aluminium adalah +3 di semua senyawanya.
Dua nama lain yang mungkin untuk merujuk ke Al (OH)3 Mereka adalah: aluminium trihydroxide, menurut nomenklatur sistematis dan penggunaan pembilang Yunani; dan aluminium hidroksida, diakhiri dengan akhiran -ICO untuk memiliki keadaan oksidasi tunggal.
Meskipun di bidang kimia nomenklatur Al (OH)3 Itu tidak mewakili tantangan atau kebingungan apa pun, di luarnya cenderung dicampur dengan ambiguitas.
Misalnya, Gibbsita Mineral adalah salah satu polimorf alami AL (OH)3, yang juga mereka sebutkan sebagai γ-al (OH)3 atau α-al (OH)3. Namun, α-al (OH)3 Ini juga dapat sesuai dengan mineral Bayerita, atau β-al (OH)3, Menurut nomenklatur kristalografi. Sementara itu, polimorf Nordstrandita dan Doyleita biasanya ditetapkan hanya sebagai (OH)3.
Daftar berikut dengan jelas merangkum yang baru dijelaskan:
-Gibbsita: (γ atau α) -al (OH)3
-Bayerita: (α atau β) -al (OH)3
-Nordstrandita: AL (OH)3
-Doyleita: AL (OH)3
Aplikasi
Bahan baku
Penggunaan langsung untuk aluminium hidroksida adalah sebagai bahan baku untuk produksi alumina atau senyawa lainnya, aluminium anorganik atau organik; Misalnya: ALCL3, Dengan tidak3)3, Alf3 atau naal (oh)4.
Dukungan Katalitik
Nanopartikel AL (OH)3 Mereka dapat bertindak sebagai dukungan katalitik; Artinya, katalis bergabung dengan mereka untuk diperbaiki pada permukaannya, di mana reaksi kimia dipercepat.
Dapat melayani Anda: reaksi sintesis: jenis, faktor, contohSenyawa Internasional
Di bagian Struktur dijelaskan bahwa AL (OH)3 Itu terdiri dari lapisan atau lembaran A dan B, ditambah untuk menentukan kristal. Di dalamnya, ada ruang oktahedral kecil atau lubang yang dapat ditempati oleh ion lain, logam atau organik, atau molekul netral.
Saat kristal disintesis dari (OH)3 Dengan modifikasi struktural ini, dikatakan bahwa senyawa interkalasi sedang disiapkan; yaitu, diselingi atau menempatkan spesies kimia di antara lembaran A dan B. Dengan melakukan itu, bahan baru yang diproduksi dari hidroksida ini muncul.
Retardant Api
AL (OH)3 Ini adalah penghambat api yang baik yang menemukan aplikasi sebagai bahan pengisian dari banyak matriks polimer. Ini karena menyerap panas untuk melepaskan uap air, seperti yang dilakukan Mg (OH)2 atau Brucita.
Obat
AL (OH)3 Ini juga merupakan keasaman penetral, bereaksi dengan HCl sekresi lambung; Sekali lagi, mirip dengan bagaimana hal itu terjadi dengan MG (OH)2 susu magnesia.
Kedua hidroksida dapat dicampur dalam antasida yang berbeda, digunakan untuk meringankan gejala orang yang menderita gastritis atau borok lambung.
Adsorben
Ketika dipanaskan di bawah titik lelehnya, aluminium hidroksida diubah menjadi alumina yang diaktifkan (serta karbon aktif). Padatan ini digunakan sebagai adsorben molekul yang tidak diinginkan, baik pewarna, kotoran, atau gas yang berpolusi.
Risiko
Risiko yang dapat mewakili aluminium hidroksida bukan karena itu padat, tetapi sebagai obat. Tidak ada protokol atau peraturan yang diperlukan untuk menyimpannya, karena tidak bereaksi keras dengan agen pengoksidasi, dan itu juga tidak mudah terbakar.
Ketika dicerna dalam antasida yang dicapai di apotek, efek samping yang tidak diinginkan mungkin muncul, seperti sembelit dan penghambatan usus fosfat. Juga, dan meskipun tidak ada penelitian untuk menunjukkannya, itu telah dikaitkan dengan gangguan neurologis seperti penyakit Alzheimer.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Aluminium hidroksida. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi. (2019). Aluminium hidroksida. Database pubchem. CID = 10176082. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Danielle Reid. (2019). Hydroxide Aluminium: Formula & Efek Samping. Belajar. Pulih dari: belajar.com
- Robert Schoen & Charles dan. Roberson. (1970). Struktur aluminium hidroksida dan implikasi geokimia. The American Mineralogist, Vol 55.
- Vitaly p. Isupov & col. (2000). Sintesis, struktur, sifat, dan penerapan senyawa interkalasi aluminium hidroksida. Kimia untuk Pembangunan Berkelanjutan 8.121-127.
- Narkoba. (24 Maret 2019). Efek samping aluminium hidroksida. Pulih dari: obat -obatan.com
- « Sejarah vanadio, properti, struktur, penggunaan
- Sejarah Nikel, Properti, Struktur, Penggunaan, Risiko »

