Barium hidroksida (BA (OH) 2)

- 2003
- 605
- Miss Marion Graham
 Barium hidroksida digunakan untuk tujuan yang berbeda di berbagai industri. Dengan lisensi
Barium hidroksida digunakan untuk tujuan yang berbeda di berbagai industri. Dengan lisensi Apa itu barium hidroksida?
Dia Barium hidroksida Ini adalah senyawa kimia dari formula ba (OH)2(H₂O)X. Ini adalah dasar yang kuat dan dapat dalam bentuk anhidrat, monohidrat atau octohydrate. Bentuk monohidrasi, juga disebut Barita Agua, adalah yang paling umum dan penggunaan komersial.
Barium hidroksida dapat disiapkan dengan melarutkan barium oksida (BAO) dalam air: Bao + 9h2O → BA (OH)2· 8h2SALAH SATU. Itu mengkristal seperti octahydrate, yang menjadi monohidrat saat memanaskan di udara. Pada 100 ° C kosong, monohidrat akan menghasilkan bao dan air.
Sifat barium hidroksida
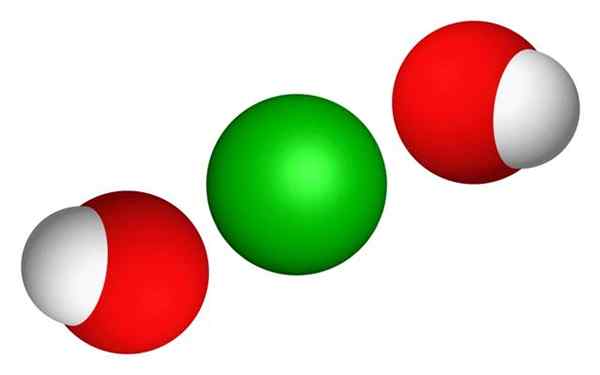 Struktur kimia 3D barium hidroksida. Domain Publik, Wikimedia Commons.
Struktur kimia 3D barium hidroksida. Domain Publik, Wikimedia Commons. - Barium hidroksida adalah kristal oktahédic putih atau transparan. Kurang bau dan rasa kaustik.
- Bentuk anhidra memiliki berat molekul 171,34 g/mol, kepadatan 2,18 g/ml, titik fusi 407 ° C dan titik mendidih 780 ° C.
- Bentuk monohidrasi memiliki berat molekul 189.355 g/mol, kepadatan 3.743 g/ml dan titik leleh 300 ° C.
- Bentuk octohydrate memiliki berat molekul 315,46 g/mol, kepadatan 2,18 g/ml dan titik leleh 78 ° C.
- Senyawa ini sedikit larut dalam air dan tidak larut dalam aseton. Ini adalah basis yang kuat dengan PKA 0,15 dan 0,64 untuk yang pertama dan kedua OH- masing -masing.
- Barium hidroksida bereaksi mirip dengan natrium hidroksida (NaOH), tetapi lebih sedikit larut dalam air.
- Menetralkan asam eksotermik untuk membentuk garam lebih banyak air.
- Ini dapat bereaksi dengan aluminium dan seng untuk membentuk oksida logam atau hidroksida dan menghasilkan hidrogen gas.
- Anda dapat memulai reaksi polimerisasi dalam senyawa organik yang dapat dipolimerisasi, terutama epoksi.
- Ini dapat menghasilkan gas yang mudah terbakar dan/atau beracun dengan garam amonium, nituro, senyawa organik terhalogenasi, berbagai logam, peroksida dan hidroperoksida. Campuran karet terklorinasi meledak saat dipanaskan atau dihancurkan.
Dapat melayani Anda: larutan encer- Barium hidroksida pecah menjadi barium oksida saat dipanaskan pada 800 ° C. Reaksi karbon dioksida menghasilkan barium karbonat. Larutan berairnya, sangat basa, mengalami reaksi netralisasi dengan asam. Dengan demikian, barium sulfat dan barium fosfat terbentuk masing -masing dengan asam sulfat dan fosfat.
H2Sw4 + Ba (oh)2 Baso4 + 2h2SALAH SATU
- Reaksi hidrogen sulfida menghasilkan barium sulfida. Pengendapan banyak garam barium yang tidak larut, atau kurang larut, dapat dihasilkan dari reaksi penggantian ganda ketika larutan air barium hidroksida dicampur dengan banyak larutan dari garam logam lainnya.
- Campuran hidroksida terhidrasi padat dengan padat amonik klorida dalam gelas menghasilkan reaksi endotermik untuk menghasilkan cairan, dengan evolusi amonia. Suhu berkurang secara dramatis hingga sekitar -20ºC.
Ba (oh)2 (s) + 2nh4Cl (S) → BACL2 (aq) + 2nh3 (g) + h2SALAH SATU
- BA (OH) 2 bereaksi dengan karbon dioksida untuk menghasilkan barium karbonat. Ini diekspresikan oleh reaksi kimia berikut:
BA (OH) 2 + CO2 → BACO3 + H2O.
Reaktivitas dan bahaya
Barium hidroksida diklasifikasikan sebagai senyawa yang stabil, tidak berbahan bakar, yang bereaksi dengan cepat dan eksotermis dengan asam, tidak kompatibel dengan karbon dioksida dan kelembaban. Senyawa ini beracun dan, sebagai basis yang kuat, bersifat korosif.
Inhalasi, konsumsi atau kontak kulit dengan material dapat menyebabkan cedera serius atau kematian. Kontak dengan zat cair dapat menyebabkan luka bakar parah pada kulit dan mata.
Efek kontak atau inhalasi dapat ditunda. Api dapat menghasilkan gas yang menjengkelkan, korosif dan/atau beracun. Air limbah kontrol kebakaran bisa korosif dan/atau toksik dan menyebabkan kontaminasi.
Dapat melayani Anda: garam asam (oksisal)Kontak mata
Jika senyawa bersentuhan dengan mata, lensa kontak harus diperiksa dan dilepas. Mata dengan banyak air selama setidaknya 15 menit, dengan air dingin harus segera dicuci.
Kontak kulit
Dalam hal kontak kulit, area yang terkena harus dibilas segera selama setidaknya 15 menit dengan banyak.
Cuci pakaian dan sepatu sebelum Anda menggunakannya lagi. Jika kontaknya serius, cuci dengan sabun desinfektan dan tutupi kulit yang terkontaminasi dengan krim antibakteri.
Inhalasi
Dalam hal inhalasi, korban harus ditransfer ke tempat yang baru. Jika Anda tidak bernafas, pernapasan buatan diberikan. Jika bernapas sulit, berikan oksigen.
Proses menelan
Jika senyawa dicerna, muntah tidak boleh diinduksi. Pakaian ketat longgar seperti leher kemeja, sabuk atau dasi.
Dalam semua kasus, perawatan medis segera harus diperoleh.
Aplikasi
1. Industri
- Barium hidroksida digunakan sebagai pendahulu dari senyawa barium lainnya. Monohidrat digunakan untuk mendehidrasi dan menghilangkan sulfat dari berbagai produk. Aplikasi industri ini juga berlaku untuk penggunaan laboratorium.
- Ini digunakan sebagai aditif dalam termoplastik (seperti resin fenolik), rayon dan penstabil PVC untuk meningkatkan sifat plastik. Bahan ini digunakan sebagai aditif penggunaan umum untuk pelumas dan lemak.
- Aplikasi industri lainnya termasuk pembuatan gula, sabun, saponifikasi lemak, fusi silikat dan sintesis kimia senyawa barium lainnya dan senyawa organik lainnya.
2. Laboratorium
- Ini digunakan dalam kimia analitik untuk titrasi asam lemah, terutama asam organik. Dijamin bahwa larutan berair transparannya bebas karbonat, tidak seperti natrium hidroksida dan kalium hidroksida, karena barium karbonat tidak larut dalam air.
Dapat melayani Anda: senyawa khusus: karakteristik, pelatihan, penggunaanIni memungkinkan Anda untuk menggunakan indikator seperti fenolftalein atau timofthalein (dengan perubahan warna alkali) tanpa risiko kesalahan titrasi yang disebabkan oleh adanya ion karbonat, yang jauh lebih mendasar yang kurang mendasar.
- Ini digunakan sesekali dalam sintesis organik sebagai dasar yang kuat, misalnya untuk hidrolisis ester dan nitril.
- Ini juga digunakan dalam dekarboksilasi asam amino yang melepaskan barium karbonat dalam proses.
- Ini juga digunakan dalam persiapan siklopentanon, alkohol diacetone dan gamma-lactone D-gulonic.
3. Katalis dalam reaksi Wittig-Horner
Reaksi Wittig-Horner, juga dikenal sebagai Horner-Wadsworth-Emmons (atau reaksi HWE) adalah reaksi kimia yang digunakan dalam kimia organik untuk menstabilkan carbanion fosfonat dengan aldehida (atau keton) untuk menghasilkan e-alqueo yang dominan (trans transit).
Reaksi soncocochemic horner wittig dikatalisis oleh barium hidroksida teraktivasi dan dilakukan dalam kondisi antarmuka yang cair padat.
Proses Soncoquímico berlangsung pada suhu kamar dan dengan berat katalis yang lebih rendah dan waktu reaksi daripada proses termal. Dalam kondisi ini, hasil yang mirip dengan proses termal diperoleh.
Sifat situs aktif katalis yang bertindak dalam proses dianalisis. Mekanisme diusulkan oleh proses soncoquímico.
4. Penggunaan lainnya
Barium hidroksida memiliki kegunaan lain, seperti:
- Pembuatan alkali.
- Konstruksi kaca.
- Vulkanisasi karet sintetis.
- Inhibitor korosi.
- Sebagai cairan pengeboran, pestisida dan pelumas.
- Untuk obat boiler.
- Untuk memperbaiki minyak nabati dan hewani.
- Untuk cat segar.
- Dalam pelunakan air.
- Sebagai bahan obat homeopati.
- Untuk membersihkan tumpahan asam.
- Ini juga digunakan dalam industri gula untuk menyiapkan gula bit.
- Bahan bangunan.
- Produk listrik dan elektronik.
- Pelapis tanah.
Referensi
- Barium hidroksida (s.F.). Dipulihkan dari ChemistryLearner.com.
- Barium hidroksida (s.F.). Pulih dari chemicalland21.com.
- « Nama epik dan legendaris (pria dan wanita)
- Voges-Proskauer Test Apa itu, fondasi, persiapan, penggunaan »

