Strontium hidroksida (SR (OH) ₂)

- 2202
- 150
- Domingo Gutkowski
 Strontium hidroksida
Strontium hidroksida Apa itu strontium hidroksida?
Dia Strontium hidroksida (SR (OH) ₂) adalah senyawa kimia anorganik yang dibentuk oleh ion strontium (SR) dan dua ion hidroksida (OH). Senyawa ini diperoleh dengan menggabungkan garam strol dengan basa yang kuat, menghasilkan senyawa sifat alkali yang formula kimianya adalah SR (OH)2.
Secara umum, untuk persiapan strontium hidroksida, natrium hidroksida (NaOH) atau kalium hidroksida (KOH) digunakan sebagai dasar yang kuat. Di sisi lain, garam strontium (atau ion strontium) yang bereaksi dengan basa yang kuat adalah nitrat strontium SR (tidak3)2 Dan prosesnya dijelaskan oleh reaksi kimia berikut:
2koh + sr (tidak3)2 → 2kno3 + Sr (oh)2
Dalam larutan kation strontium (SR+) Dia menghubungi Hydroxide Anion (oh-) membentuk garam strontium ionik dasar. Karena strontium adalah logam alkali, strontium hidroksida dianggap sebagai senyawa alkali kaustik.
Memperoleh strontium hidroksida
Selain proses yang dijelaskan sebelumnya, dapat dikatakan bahwa begitu reaksi dilakukan, SR (OH)2 mengendap dalam larutan. Maka ini mengalami proses pencucian dan pengeringan, akhirnya mendapatkan bubuk putih yang sangat halus.
Metode alternatif untuk mendapatkan strontium hidroksida adalah dari pemanasan strontium karbonat (SRCO3) atau strontium sulfat (SRSO4), dengan uap pada suhu berkisar antara 500 ° C dan 600 ° C. Reaksi kimia terjadi seperti yang ditunjukkan di bawah ini:
Srco3 + H2O → SR (OH)2 + BERSAMA2
SRS + 2H2O → SR (OH)2 + H2S
Dapat melayani Anda: asam belerangStruktur kimia dan sifat fisikokimia
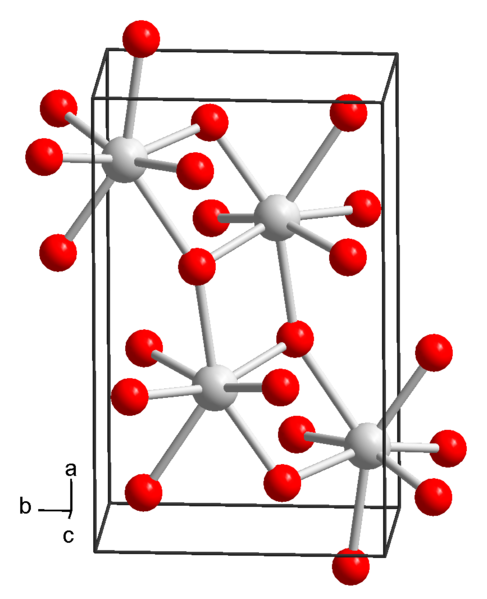 Struktur kimia strontium hidroksida. Sumber: Wikimedia Commons
Struktur kimia strontium hidroksida. Sumber: Wikimedia Commons Saat ini, 3 bentuk strontium hidroksida diketahui: oktahidrat, monohidrat dan anhidrat.
Strontium hidroksida octonated
Dari solusi dalam kondisi suhu dan tekanan normal (25 ° C dan 1 atm), strontium hidroksida endapan dengan cara oktahidrat, yang formula kimianya adalah SR (OH)2∙ 8H2SALAH SATU.
Senyawa ini memiliki massa molar 265,76 g/mol, kepadatan 1,90 g/cm dan endapan sebagai kristal tetragonal (dengan kelompok spasial P4/NCC) dari penampilan prismatik segi empat dan tidak berwarna dan tidak berwarna.
Demikian juga, strontium hidroksida oktonisasi memiliki kemampuan untuk menyerap kelembaban atmosfer, karena merupakan senyawa yang mudah lezat.
Strontium hidroksida monohidrasi
Menurut studi mikroskop optik (dilakukan oleh teknik difraksi x -ray), dengan menaikkan suhu menjadi sekitar 210 ° C - tekanan atmosfer yang konstan - SR (OH)2∙ 8H2O Dehidrasi dan diubah menjadi strontium hidroksida monohidrasi (SR (OH)2∙ h2SALAH SATU).
Bentuk senyawa ini memiliki massa molar 139,65 g/mol dan suhu lelehnya -73,15 ° C (375K). Karena konfigurasi atomnya, ini menyajikan lebih sedikit kelarutan dalam air daripada yang dijelaskan dalam bentuk oktahidratnya.
Anhydrous strontium hidroksida
Dengan melanjutkan dengan peningkatan suhu sistem menjadi sekitar 480 ° C, dehidrasi diperpanjang sampai peregangan hidroksida anhidrat.
Tidak seperti bentuk terhidrasi, ia memiliki massa molar 121,63 g/mol dan kepadatan 3.625 g/cm3. Titik didihnya tercapai pada 710 ° C (1.310 ° F atau 983 K) sedangkan titik leleh pada 535 ° C (995 ° F atau 808 K).
Dapat melayani Anda: ididio 192Kelarutan
Strontium octahydrate hidroksida memiliki kelarutan air 0,91 gram per 100 mililiter (diukur pada 0 ° C), sedangkan bentuk anhidratnya pada kondisi suhu yang sama memiliki kelarutan 0,41 gram per 100 mililiter.
Demikian pula, zat ini dianggap tidak larut dalam aseton dan benar -benar larut dalam asam dan amonium klorida.
Reaktivitas kimia
Strontium hidroksida tidak mudah terbakar, reaktivitas kimianya tetap stabil pada suhu dan tekanan sedang, dan mampu menyerap karbon dioksida dari udara atmosfer, mengubahnya menjadi strontium karbonat.
Selain itu, ini adalah senyawa yang sangat menjengkelkan jika Anda berhubungan dengan kulit, saluran pernapasan atau selaput lendir lainnya.
Penggunaan strontium hidroksida
Karena karakteristik higroskopis dan sifat dasarnya, strontium hidroksida digunakan untuk aplikasi yang berbeda dalam industri:
- Ekstraksi moice dan pemurnian gula dari bit.
- Penstabil plastik.
- Lemak dan pelumas.
Ekstraksi moice dan pemurnian gula bit
Pada awal abad ke -21, di Jerman, peregangan hidroksida mulai digunakan untuk pemurnian bit dari bit, melalui proses yang dipatenkan oleh Carl Scheibler pada tahun 1882.
Prosedur ini terdiri dalam campuran strontium hidroksida dan bubur bit manis, yang menghasilkan disakarida yang tidak larut. Solusi ini dipisahkan oleh dekantasi dan setelah proses pemurnian dilakukan, gula diperoleh sebagai produk akhir.
Meskipun prosedur ini masih digunakan, ada metode lain dengan lebih banyak permintaan untuk menjadi lebih murah, yang digunakan di sebagian besar kilang gula dunia. Misalnya, metode barsil, yang menggunakan Barium silikat, atau metode Steffen, menggunakan kapur sebagai agen ekstraktor.
Dapat melayani Anda: karbon anomer: apa itu, karakteristik, contohLemak strontium
Mereka adalah lemak pelumas yang mengandung strontium hidroksida. Ini mampu sangat mematuhi permukaan dengan karakteristik logam, tahan air dan mendukung perubahan suhu mendadak.
Karena stabilitas fisik dan kimianya yang baik, lemak ini digunakan sebagai pelumas industri.
Penstabil plastik
Sebagian besar plastik, terpapar faktor iklim seperti matahari, hujan dan oksigen atmosfer, memodifikasi sifatnya dan menurunkan.
Karena ketahanan airnya yang besar, strontium hidroksida ditambahkan ke polimer ini - selama fase fusi - bertindak sebagai penstabil dalam pembuatan produk plastik untuk memperpanjang masa manfaatnya.
Aplikasi lain
- Dalam industri cat digunakan sebagai aditif penting untuk mempercepat proses pengeringan dalam lukisan komersial dan industri.
- Dari strontium hidroksida, garam atau ion strontium diperoleh, yang digunakan sebagai bahan baku untuk produksi artikel piroteknik.
Referensi
- Wikipedia (n.D.). Strontium hidroksida. Diterima dari.Wikipedia.org
- Pubchem (S.F.). Strontium hidroksida. Diperoleh dari pubchem.NCBI.Nlm.Nih.Pemerintah
- Honeywell (s.F.). Stontium hidroksida octahydrate. Diperoleh dari Honeywell.com

