Struktur natrium hidroksida (NaOH), sifat, penggunaan, sintesis

- 2454
- 718
- Miss Marion Graham
Dia Sodium hidroksida Ini adalah senyawa anorganik yang formula kimianya adalah NaOH dan terdiri dari basis logam yang sangat kuat atau alkali. Solusi 5 %dalam air memiliki pH mendekati 14.
Ini adalah padatan putih yang sangat higroskopis dan yang juga dapat menyerap karbon dioksida udara untuk membentuk natrium karbonat. Secara komersial datang dalam botol plastik seperti pil, yang tidak dapat diekspos terlalu banyak waktu di udara, juga tidak boleh dimanipulasi dengan spatula.
 Pil natrium hidroksida pada gelas jam. Sumber: Tidak ada penulis yang dapat dibaca mesin yang disediakan. Walkerma diasumsikan (berdasarkan klaim hak cipta). [Area publik]
Pil natrium hidroksida pada gelas jam. Sumber: Tidak ada penulis yang dapat dibaca mesin yang disediakan. Walkerma diasumsikan (berdasarkan klaim hak cipta). [Area publik] Sodium hidroksida dapat disintesis saat bereaksi kalsium hidroksida dengan natrium karbonat. Saat ini, secara fundamental disintesis oleh elektrolisis air garam, dan merupakan produk sekunder dari produksi klorin gas.
Memberi. Ini juga digunakan dalam pembersihan rumah, pengolahan air, pemrosesan aluminium, pembuatan obat, dll.; Dan yang terpenting, ini adalah pola sekunder par excellence.
Sodium hidroksida sangat korosif, mampu menghasilkan iritasi dan luka bakar kulit dan mata. Dengan menghirup debu, ia dapat menyebabkan edema paru. Sementara itu, konsumsi dapat menyebabkan cedera serius pada saluran pencernaan yang dapat menyebabkan kematian.
[TOC]
Struktur
Anhidrat
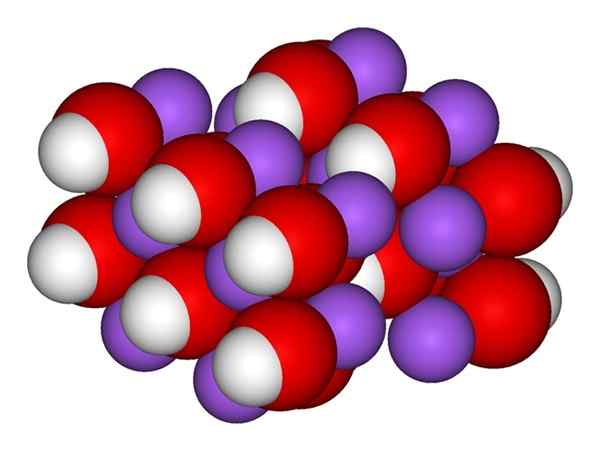
 Ion NaOH. Sumber: Gabriel Bolívar.
Ion NaOH. Sumber: Gabriel Bolívar. Gambar superior menunjukkan ion yang membentuk NaOH. Kation+ Itu diwakili oleh bola ungu, sedangkan anion hidroksil (hidroksida atau oksidril) oh- Untuk bidang merah dan putih. Kedua ion Na+ dan oh- mereka berinteraksi satu sama lain dengan daya tarik elektrostatik dari beban yang berlawanan.
 Struktur natrium hidroksida
Struktur natrium hidroksida Interaksi seperti itu tidak dirugikan, jadi atraksi na ionik+Oh- dapat mempengaruhi orang lain pada jarak tertentu. Hasilnya adalah ion na+ Mereka saling mengusir, dengan cara yang sama seperti oh-, Sampai mendefinisikan kristal energi minimum di mana mereka membangun struktur tertib dan periodik (kristal).
Oleh karena itu muncul kristal ortorombik NaOH anhydro (tanpa air):
 Representasi struktur kristal natrium hidroksida anhidrat. Sumber: Quibik via Wikipedia.
Representasi struktur kristal natrium hidroksida anhidrat. Sumber: Quibik via Wikipedia. Ion tetap cukup kohesif untuk kristal anhidrat NaOH ke dasar 323 ºC (asalkan tidak ada kelembaban di lingkungan).
Melembabkan
Keduanya na+ Seperti oh- Mereka adalah ion yang mudah dimasukkan oleh molekul air (hidrat). Ini mendukung hidrasi di atas energi reticular kristal, jadi NaOH melepaskan banyak energi ketika bersentuhan dengan air.
Itu dapat melayani Anda: reaksi fehling: persiapan, agen aktif, contoh, penggunaanNamun, kristal anhidrat dapat menampung molekul air tanpa larut; yaitu, natrium hidroksida dapat membentuk banyak hidrat, NaOH · NH2SALAH SATU. Molekul air mungkin membentuk jembatan hidrogen dengan OH- (Hoh-oh-), atau berkoordinasi dengan NA+ (Na+-Oh2).
Tergantung pada proporsi molar antara NaOH dan h2Atau, monohidrat dapat muncul (NaOH · h2O), dihidrat (NaOH · 2H2O), trihemacrates (NaOH · 3.5H2O), tetrahydrates (NaOH · 4H2O), heptahridates (NaOH · 7h2O), dan lainnya.
Setiap hidrat ini dapat mengkristal dari larutan NaOH berair dengan persentase massa yang berbeda dan pada suhu yang berbeda. Akibatnya, NaOH menunjukkan diagram kelarutan air yang rumit.
Secara umum, kristal hidrat kurang padat dan memiliki titik leleh yang lebih rendah. Ini karena molekul air "menghambat" interaksi antara Na+ dan oh-, Menambahkan pasukan dipol-dipol dalam pengorbanan atraksi ionik.
Sifat fisik dan kimia
Nama
IUPAC Preferred Name: Sodium Hydroxide. Nama Lain: Soda kaustik, Ascarita (kurang umum)
Masa molar
39.9971 g/mol
Penampilan
Kristal padat atau putih, serosa atau buram.
Titik lebur
323 ºC
Titik didih
1.388 ºC
Kelarutan air
1.000 g/l pada suhu 25 ºC. Ini menunjukkan berapa banyak yang bisa larut dalam air.
Solusi berairnya kental, dengan nilai viskositas mendekati delapan puluh kali lebih besar dari air, dan melepaskan sangat panas di awal. Jika Anda memiliki kontak dengan mereka, mereka memutar kulit yang licin, karena saponifikasi asam lemak kulit.
Basicity (PKB)
- 0,56
ph
Solusi P/P 5 % dalam air memiliki pH mendekati 14
Indeks refraksi (ND)
Pada panjang gelombang 580,4 nm: 1.433 hingga 320 ºC, dan 1.421 hingga 420 ° C.
Stabilitas
Wadah yang mengandungnya harus ditutup rapat untuk mencegah pembentukan natrium karbonat. Ini karena higroskopisitasnya yang tinggi, yang membuatnya menyerap kelembaban lingkungannya dan konten rekannya2.
Penguraian
Saat dipanaskan hingga dekomposisi mengeluarkan asap dari natrium oksida.
Titik pengarahan diri sendiri
Itu tidak mudah terbakar
Zat yang lengket dan kental
4.0 cpoise pada 350 ºC
Panas penguapan
175 kJ/mol A 1.388 ºC
Tegangan permukaan
74,35 Dynas/cm dalam larutan 2,72 % P/P dalam air pada 18 ° C.
Reaktivitas
Dengan asam
Bereaksi dengan asam mineral organik dan anorganik, menyebabkan air dan garam yang sesuai. Dalam kasus asam sulfat, reaksinya eksotermik.
Dapat melayani Anda: aluminium sulfida (al2s3): struktur, sifat, penggunaan2 NaOH+H2Sw4 => Na2Sw4 + 2 h2SALAH SATU
Dengan asam oksida
Bereaksi dengan sulfur dioksida, misalnya, memberikan garam sulfit dan air:
2 NaOH +Jadi2 => Na2Sw3 + H2SALAH SATU
Dengan logam
Larutan berairnya bereaksi dengan beberapa logam untuk menyebabkan garam natrium kompleks. Misalnya, reaksinya dengan seng memunculkan zincato natrium:
Zn + 2 NaOH + 2 H2O => na2[Zn (OH)4] + H2
Perpaduan
Sodium hidroksida terutama disintesis dengan dua metode: penggunaan natrium karbonat, awalnya digunakan, dan elektrolisis natrium klorida, saat ini digunakan industri yang lebih besar.
Reaksi natrium karbonat dan kalsium hidroksida
Sodium karbonat bereaksi dengan kalsium hidroksida dalam proses yang dikenal sebagai kebiasaan:
CA (OH)2 + Na2BERSAMA3 => Caco3 + Naoh
Kalsium karbonat endapan, meninggalkan natrium hidroksida dalam supernatan, yang terkonsentrasi dengan penguapan.
Sodium karbonat sebelumnya berasal dari proses solvay:
2 NaCl+ Caco3 => Na2BERSAMA3 + CACL2
Elektrolisis natrium klorida
Elektrolisis natrium klorida, hadir dalam air garam, menghasilkan gas hidrogen, gas klorida dan natrium hidroksida dalam larutan berair:
2 NaCl+2 H2O => h2 + Cl2 + 2 NaOH
Ruang elektrolitik terdiri dari kompartemen di mana anoda (+), logam titanium, dan situs tempat air garam ditempatkan. Kompartemen ini dipisahkan dari kompartemen katoda (-) menggunakan membran berpori.
Reaksi berikut terjadi di anoda:
2 Cl- => Cl2 + 2 e- (oksidasi)
Sementara itu, reaksi ini terjadi di katoda:
2 h2O +2 e- => H2 + Oh- (pengurangan)
Natrium (na+) berdifus dari kompartemen anoda ke katoda, melalui membran yang memisahkannya, membentuk natrium hidroksida.
Aplikasi
Produk pembersih
Sodium hidroksida digunakan untuk pembuatan sabun dan deterjen yang digunakan di rumah dan dalam aktivitas komersial. Kombinasi natrium dan klorin hidroksida menghasilkan pemutih klorin, digunakan dalam pencucian pakaian putih.
Ini juga menghilangkan akumulasi lemak di saluran air, menghasilkan eliminasinya melalui konversi menjadi sabun melalui proses saponifikasi. Ini memungkinkan penghapusan penghalang pipa rumah tangga dan bangunan lainnya.
Produk farmasi dan obat
Sodium hidroksida digunakan dalam elaborasi analgesik umum, seperti aspirin. Juga obat -obatan dengan aksi antikoagulan yang menghalangi pembentukan gumpalan darah dan obat -obatan untuk mengurangi hiperkolesterolemia.
Proses energi
Sodium hidroksida digunakan dalam pembuatan sel bahan bakar yang berfungsi sebagai baterai untuk menghasilkan listrik untuk berbagai aplikasi, termasuk transportasi. Resin epoksi, diproduksi dengan intervensi natrium hidroksida, digunakan dalam turbin angin.
Itu dapat melayani Anda: Galvanic Corrosion: Mekanisme, Contoh, PerlindunganPengolahan air
Sodium hidroksida digunakan untuk menetralkan keasaman air dan berkontribusi pada penghapusan logam berat. Ini juga digunakan untuk produksi natrium hipoklorit, desinfektan air.
Sodium hidroksida bereaksi dengan aluminium sulfat untuk pembentukan aluminium hidroksida: zat flokulan yang digunakan dalam tanaman pengolahan air untuk meningkatkan sedimentasi partikel, menghasilkan klarifikasinya.
Pembuatan kertas
Sodium hidroksida digunakan dengan natrium sulfida dalam pengolahan kayu untuk mendapatkan selulosa, dengan cara yang hampir murni, yang membentuk dasar kertas. Ini juga digunakan dalam daur ulang kertas, karena dengan membantu memisahkan tinta, itu memungkinkan kita untuk menggunakannya lagi.
Manufaktur industri
Sodium hidroksida digunakan dalam pembuatan rayón, spandex, bahan peledak, resin epoksi, kaca dan keramik. Ini digunakan dalam industri tekstil untuk pewarna, dan memproses kain kapas.
Pada tanaman pengolahan tebu, natrium hidroksida suhu rendah digunakan untuk produksi tebu.
Risiko
Sodium hidroksida adalah senyawa yang sangat korosif, sehingga dapat menyebabkan, dengan kontak dengan kulit, luka bakar, ampul dan bahkan bekas luka permanen.
Dalam kontak dengan mata, itu dapat menghasilkan luka bakar yang serius, pembengkakan, rasa sakit, penglihatan kabur, dan dalam kasus yang parah, itu dapat menyebabkan kebutaan permanen.
Konsumsi natrium hidroksida dapat menyebabkan luka bakar pada bibir, lidah, tenggorokan, kerongkongan dan lambung. Di antara gejala yang biasa, mual, muntah, kram perut dan diare dimanifestasikan.
Meskipun inhalasi natrium hidroksida jarang terjadi, dan hanya dapat terjadi karena adanya debu senyawa di udara atau dengan pembentukan embun yang mengandungnya, ia menghasilkan iritasi di paru -paru.
Dalam kasus paparan kronis, ini dapat menyebabkan edema paru dan pemendekan pernapasan parah, yang merupakan keadaan darurat medis.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Sodium hidroksida. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi. (2019). Sodium hidroksida. Database pubchem. CID = 14798. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Elemen Amerika. (2019). Larutan natrium hidroksida. Diperoleh dari: Amerika.com
- Fakta Keselamatan Kimia. (2019). Sodium hidroksida. Pulih dari: chemicalsafetyfacts.org
- NJ Health. (2015). Sodium hidroksida. [PDF]. Pulih dari: NJ.Pemerintah
- Pusat Kesehatan & Keselamatan Kerja Kanada. (2019). Osh menjawab lembar fakta: natrium hidroksida. Pulih dari: cohs.Ac
- Ausetute. (S.F.). Sodium hidroksida dan produksi klorin dengan elektrolisis. Pulih dari: ausetute.com.Au
- « Asal bahasa chol, karakteristik, di mana Anda diucapkan, kata -kata
- Karakteristik majalah yang diindeks, kriteria, contoh yang berpengaruh »

