Holmio

- 1475
- 317
- Frederick Pfeffer
 Sampel Ultrapure Holm Logam. Sumber: Gambar Hi-Res Elemen ofchemical [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]
Sampel Ultrapure Holm Logam. Sumber: Gambar Hi-Res Elemen ofchemical [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)] Apa holmio?
Dia Holmio Itu adalah elemen logam milik blok F dari tabel periodik, khususnya untuk periode lantanida. Oleh karena itu adalah anggota tanah jarang, di sebelah erbio, itrio, disposio dan iterbio. Semua ini membentuk serangkaian mineral (XenotiMa atau Gadolinita) yang sulit dipisahkan melalui metode kimia konvensional.
Simbol kimianya adalah HO, memiliki jumlah atom 67, dan kurang berlimpah dari disposio tetangganya (66Dy) dan erbio (68Er). Kemudian dikatakan bahwa aturan oddo-harkin mematuhi. Holmius adalah salah satu logam langka yang hampir tidak ada yang tahu atau mencurigai keberadaannya; Bahkan di antara bahan kimia, biasanya tidak sering disebutkan.
Di bidang kedokteran, Holmio dikenal karena penggunaan lasernya dalam operasi untuk memerangi patologi prostat. Ini juga mewakili bahan yang menjanjikan untuk pembuatan elektromagnet dan komputer kuantum, karena sifat magnetiknya yang tidak biasa.
Senyawa holmium, trivalen, ho3+, Mereka menyajikan kekhasan menunjukkan warna yang bergantung pada cahaya yang mereka nyalakan. Jika ini fluoresen, warna senyawa ini berubah dari kuning menjadi merah muda. Demikian pula, itu terjadi dengan solusinya.
Sejarah
Penemuan Holmio disebabkan oleh dua bahan kimia Swiss, Marc DeFontaine dan Jacques-Louis Soret, yang pada tahun 1878 terdeteksi secara spektroskopi saat menganalisis dalam mineral Jenewa dari tanah jangka. Mereka memanggilnya elemen x.
Hanya setahun kemudian, pada tahun 1879, ahli kimia Swedia per Teodor Cleve berhasil2SALAH SATU3). Oksida ini, yang terkontaminasi oleh kotoran lain, menunjukkan warna coklat, yang ia beri nama 'Holmia', yang berarti stroke dalam bahasa Latin.
Dapat melayani Anda: reaksi eksergonik: karakteristik dan contohJuga, Cleve memperoleh bahan hijau lain: 'Thulia', yang menjadi Tulio oksida. Masalah penemuan ini adalah bahwa tidak satu pun dari tiga bahan kimia yang dapat memperoleh sampel yang cukup murni dari holm oksida, karena terkontaminasi oleh atom Docch, logam lanthanide lain.
Itu bukan apa -apa selain pada tahun 1886 bahwa bahan kimia Prancis, Paul Lecoq dari Boisbaudran, mengisolasi holm oksida dengan presipitasi yang difraksinasi. Oksida ini kemudian menjalani reaksi kimia untuk menghasilkan garam holmio, yang dikurangi pada tahun 1911 oleh ahli kimia Swedia Otto Holmberg; Maka, sampel Holm logam pertama muncul.
Namun, saat ini ion Holmio3+, Mereka diekstraksi dengan kromatografi pertukaran ion, bukannya menggunakan reaksi konvensional.
Properti Holm
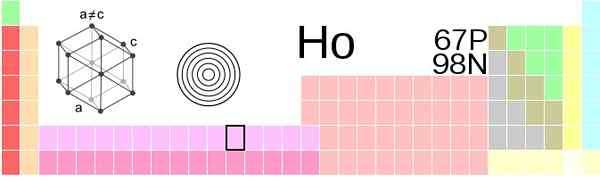 Lokasi Holmio di tabel periodik. Sumber: Vektorisasi: Sushant Savla 05:51, 9 Juni 2019 (UTC), CC BY-SA 4.0, via Wikimedia Commons
Lokasi Holmio di tabel periodik. Sumber: Vektorisasi: Sushant Savla 05:51, 9 Juni 2019 (UTC), CC BY-SA 4.0, via Wikimedia Commons Penampilan fisik
Logam perak, lembut, ulet dan lunak.
Nomor atom
67 (67Ho)
Masa molar
164.93 g/mol
Titik lebur
1461 ºC
Titik didih
2600 ºC
Kepadatan
Pada suhu kamar: 8,79 g/cm3
Tepat saat meleleh atau meleleh: 8,34 g/cm3
Panas fusi
17 kJ/mol
Panas penguapan
251 kJ/mol
Kapasitas panas molar
27.15 J/(mol · k)
Elektronegativitas
1.23 pada skala Pauling
Energi ionisasi
Pertama: 581.0 kJ/mol (ho+ gas)
Kedua: 1140 kJ/mol (ho2+ gas)
Ketiga: 2204 kJ/mol (ho3+ gas)
Konduktivitas termal
16.2 w/(m · k)
Resistivitas listrik
814 nΩ · m
Angka oksidasi
Holm dapat disajikan dalam senyawanya dengan angka atau keadaan oksidasi berikut: 0, +1 (ho+), +2 (ho2+) dan +3 (ho3+). Dari semuanya, +3 sejauh ini adalah yang paling umum dan stabil. Oleh karena itu, holm adalah logam trivalen, membentuk senyawa (ionik atau sebagian ionik) di mana ia berpartisipasi sebagai ion ho3+.
Dapat melayani Anda: etil asetatMisalnya, dalam senyawa berikut Holm ditemukan dengan nomor oksidasi +3: HO2SALAH SATU3 (Ho23+SALAH SATU32-), Ho (oh)3, Hoi3 (Ho3+yo3-) dan ho2(SW4)3.
Ho3+ Dan transisi elektroniknya bertanggung jawab atas senyawa logam ini terlihat kuning-kuning. Namun, ketika mereka memancar dengan cahaya neon, mereka berubah menjadi merah muda. Hal yang sama berlaku untuk solusi mereka.
Isotop
Holmio disajikan di alam sebagai isotop stabil tunggal: 165HO (kelimpahan 100%). Namun, ada radioisotop buatan dengan waktu setengah kehidupan yang cukup. Di antara mereka yang kita miliki:
-163Ho (T1/2 = 4570 tahun)
-164Ho (T1/2 = 29 menit)
-166Ho (T1/2 = 26.763 jam)
-167Ho (T1/2 = 3.1 jam)
Urutan dan momen magnetik
Holm adalah logam paramagnetik, tetapi dapat menjadi feromagnetik pada suhu 19 K, menunjukkan sifat magnetik yang sangat kuat. Ini ditandai dengan memiliki momen magnetik (10,6 μB) lebih besar di antara semua elemen kimia, serta permeabilitas magnetik yang tidak biasa.
Reaktivitas
Holm adalah logam yang dalam kondisi normal tidak terlalu cepat, jadi dibutuhkan untuk kehilangan kecerahannya. Namun, ketika ia dipanaskan dengan lebih ringan itu menjadi kekuningan, produk dari pembentukan lapisan oksida:
4 ho + 3 o2 → 2 ho2SALAH SATU3
Bereaksi dengan asam encer atau pekat untuk menyebabkan garam masing -masing (nitrat, sulfat, dll.). Namun dan secara mengejutkan, itu tidak bereaksi dengan asam fluorhoric, karena lapisan HOF3 melindunginya dari degradasinya.
Holmio juga bereaksi dengan semua halogen untuk menghasilkan halogenuros masing -masing (HOF3, Hocl3, Hobr3 dan hoi3).
Struktur kimia
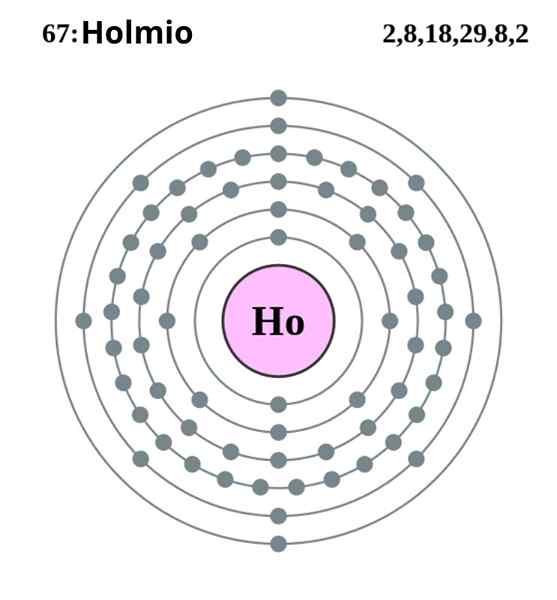 Konfigurasi Elektronik Holmio. Sumber: Pumba (karya asli oleh Greg Robson) Creative Commons Recognition-Share di bawah lisensi yang sama 2.0 Inggris dan Negara Wales
Konfigurasi Elektronik Holmio. Sumber: Pumba (karya asli oleh Greg Robson) Creative Commons Recognition-Share di bawah lisensi yang sama 2.0 Inggris dan Negara Wales The Holmio mengkristal dalam struktur heksagonal yang ringkas, HCP (untuk akronimnya dalam bahasa Inggris: heksagonal yang penuh sesak). Secara teori, atom HO tetap kohesif berkat ikatan logam yang dibentuk oleh elektron orbital 4F mereka, sesuai dengan konfigurasi elektronik mereka:
Dapat melayani Anda: pengenceran: konsep, bagaimana hal itu dilakukan, contoh, latihan[Xe] 4fsebelas 6s2
Interaksi seperti itu, serta sistem energi elektronnya, menentukan sifat fisik Holmio. Logam ini tidak diketahui alotrop atau polimorf lainnya, bahkan di bawah tekanan tinggi.
Aplikasi
Reaksi nuklir
Atom Holmio adalah penyerap neutron yang baik, sehingga membantu mengendalikan pengembangan reaksi nuklir.
Spektroskopi
Larutan Holmio Oksida digunakan untuk mengkalibrasi spektrofotometer, karena spektrum penyerapannya hampir selalu tetap, terlepas dari kotoran yang dikandungnya. Ini juga menunjukkan pita akut yang sangat khas yang terkait dengan atom Holmio, dan bukan pada senyawanya.
Pewarna
Atom Holmio mampu memberikan warna kemerahan pada kaca dan permata buatan kubik.
Magnet
Pada suhu yang sangat rendah (30 k atau kurang), Holmius menunjukkan sifat magnetik yang menarik, yang digunakan untuk memproduksi elektroma yang kuat, di mana ia membantu memusatkan medan magnet yang dihasilkan.
Bahan -bahan magnetik seperti itu ditakdirkan untuk resonansi magnetik nuklir; untuk pengembangan hard drive, dengan ingatan yang terungkap dalam urutan petabytes atau terabytes; dan mungkin memproduksi komputer kuantum.
Holmio Laser
Kristal Garnet Ititrio-Aluminium (YAG) dapat didoping dengan atom Holmio untuk memancarkan radiasi yang panjang gelombangnya 2 μm; Yaitu, kami memiliki laser holm. Berkat dia, jaringan tumor dapat dipotong justru tanpa menyebabkan pendarahan, karena energi disuplai dengan segera luka.
Laser ini telah digunakan secara berulang dalam operasi prostat dan gigi, serta untuk menghilangkan sel kanker dan batu ginjal.

