Karakteristik, fungsi, dan contoh holoenzim
- 3554
- 14
- Joseph Nader PhD
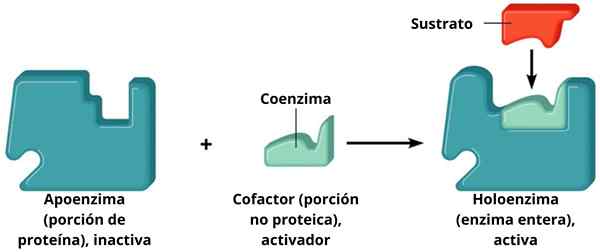
A Holoenzyme Ini adalah enzim yang dibentuk oleh bagian protein yang disebut apoenzim yang dikombinasikan dengan molekul non -protein yang disebut kofaktor. Baik pendukung maupun kofaktor tidak aktif ketika mereka secara terpisah; yaitu, agar berfungsi mereka harus digabungkan.
Dengan demikian, holoenzim adalah enzim gabungan dan, akibatnya, adalah katalis aktif. Enzim adalah jenis biomolekul yang fungsinya pada dasarnya meningkatkan kecepatan reaksi sel. Beberapa enzim membutuhkan bantuan molekul lain, yang disebut kofaktor.
 Dukungan + Cofactor = Holoenzyme
Dukungan + Cofactor = Holoenzyme Kofaktor saling melengkapi dengan dukungan dan membentuk holoenzim aktif yang melakukan katalisis. Enzim yang membutuhkan kofaktor tertentu dikenal sebagai enzim terkonjugasi. Ini memiliki dua komponen utama: kofaktor, yang dapat berupa ion logam (anorganik) atau molekul organik; Apoenzim, bagian protein.
[TOC]
Karakteristik holoenzim
Dibentuk oleh pendukung dan kofaktor
Pendukung adalah bagian protein dari kompleks, dan kofaktor dapat berupa ion atau molekul organik.
Mengakui berbagai kofaktor
Ada berbagai jenis kofaktor yang membantu membentuk holoenzim. Beberapa contoh adalah koenzim dan vitamin umum, misalnya: Vitamin B, FAD, NAD+, Vitamin C T Coenzim A.
Beberapa kofaktor dengan ion logam, misalnya: tembaga, besi, seng, kalsium dan magnesium, antara lain. Jenis kofaktor lain adalah kelompok prostetik yang disebut SO.
Persatuan temporal atau permanen
Kofaktor dapat menyatukan dukungan dengan intensitas yang berbeda. Dalam beberapa kasus, persatuannya lemah dan sementara, sedangkan, dalam kasus lain, persatuannya sangat kuat sehingga permanen.
Dalam kasus di mana persatuan bersifat sementara, ketika kofaktor dihilangkan dari holoenzyme, itu menjadi dukungan lagi dan berhenti menjadi aktif.
Fungsi
Holoenzyme adalah enzim yang siap untuk menjalankan fungsi katalitiknya; yaitu, untuk mempercepat reaksi kimia tertentu yang dihasilkan di daerah yang berbeda.
Fungsi dapat bervariasi sesuai dengan aksi holoenzim spesifik. Di antara stan terpenting DNA polimerase, yang fungsinya adalah untuk memastikan bahwa salinan DNA dilakukan dengan benar.
Dapat melayani Anda: ardipithecus: penemuan, karakteristik, tengkorakContoh holoenzim umum
RNA polimerase
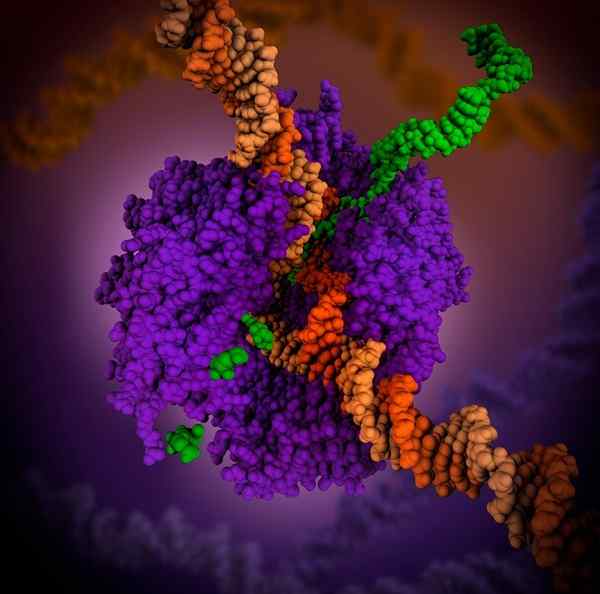 RNA polimerase 3D. Sumber: Maria Voigt., CC oleh 4.0, via Wikimedia Commons
RNA polimerase 3D. Sumber: Maria Voigt., CC oleh 4.0, via Wikimedia Commons RNA polimerase adalah holoenzim yang mengkatalisasi reaksi sintesis RNA. Holoenzim ini diperlukan untuk membangun rantai RNA dari rantai cetakan DNA yang berfungsi sebagai templat selama proses transkripsi.
Fungsinya adalah menambahkan ribonukleotida di akhir 3 molekul RNA yang tumbuh. Dalam prokariota, dukungan RNA polimerase membutuhkan kofaktor bernama Sigma 70.
DNA polimerase
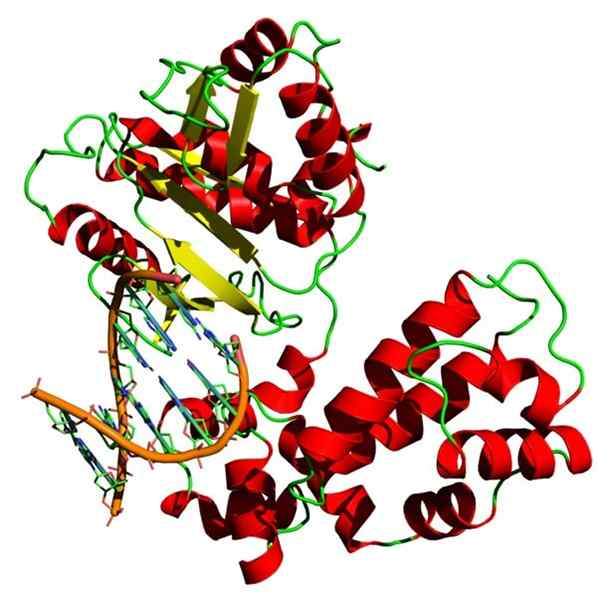 Homiens homo sapiens beta beta struktur DNA. Sumber: Yikrazuul, CC BY-SA 3.0, via Wikimedia Commons
Homiens homo sapiens beta beta struktur DNA. Sumber: Yikrazuul, CC BY-SA 3.0, via Wikimedia Commons DNA polimerase juga merupakan holoenzim yang mengkatalisasi reaksi polimerisasi DNA. Enzim ini memenuhi fungsi sel yang sangat penting karena bertanggung jawab untuk mereplikasi informasi genetik.
DNA polimerase membutuhkan ion dengan muatan positif, biasanya magnesium, untuk dapat melakukan fungsinya.
Ada beberapa jenis DNA polimerase: DNA polimerase III adalah holoenzim yang memiliki dua enzim pusat (Pol III), masing -masing senyawa dari tiga subunit (α, ɛ dan θ), klem geser yang memiliki dua subunit beta dan kompleks beban beban Pengaturan yang memiliki beberapa subunit (Δ, τ, γ, ψ, dan χ).
Karbonat anhidrase
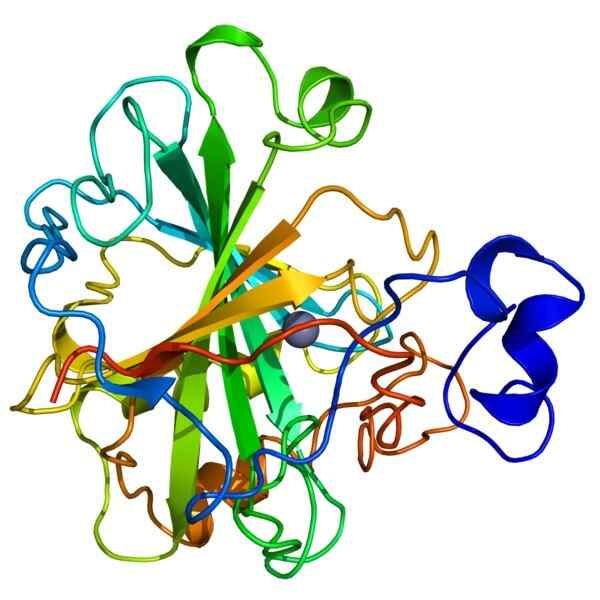 Struktur anhidrase karbonik
Struktur anhidrase karbonik Anhidrase karbonik, juga disebut dehidrasi karbonat, milik keluarga holoenzim yang mengkatalisasi konversi cepat karbon dioksida (CO₂) dan air (H20) dalam bikarbonat (H2CO3) dan proton (H+).
Enzim membutuhkan ion seng (Zn+2) sebagai kofaktor untuk melakukan fungsinya. Reaksi yang dikatalisis oleh anhidrase karbonik dapat dibalik, karena alasan ini aktivitasnya dianggap penting karena membantu menjaga keseimbangan asam-basa antara darah dan jaringan.
Hemoglobin
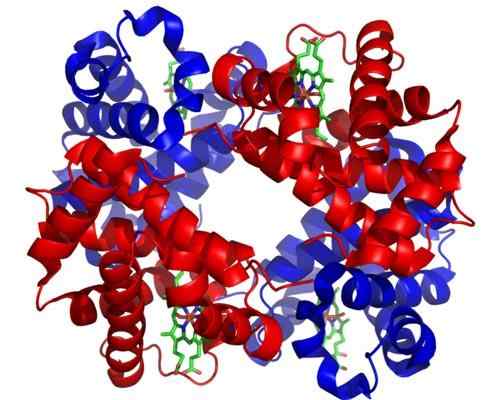 Hemoglobin
Hemoglobin Hemoglobin adalah holoenzim yang sangat penting untuk pengangkutan gas dalam jaringan hewan. Protein ini hadir dalam sel darah merah mengandung zat besi (Fe+2), dan fungsinya adalah untuk mengangkut oksigen dari paru -paru ke area tubuh lain.
Dapat melayani Anda: organisme fotosintesisStruktur molekul hemoglobin adalah tetramer, yang berarti terdiri dari 4 rantai atau subunit polipeptida.
Setiap subunit holoenzim ini mengandung gugus hemo, dan setiap kelompok hemo mengandung atom besi yang dapat bergabung dengan molekul oksigen. Kelompok hemoglobin hemo adalah kelompok prostetiknya, diperlukan untuk fungsi katalitiknya.
Sitokrom oksidase
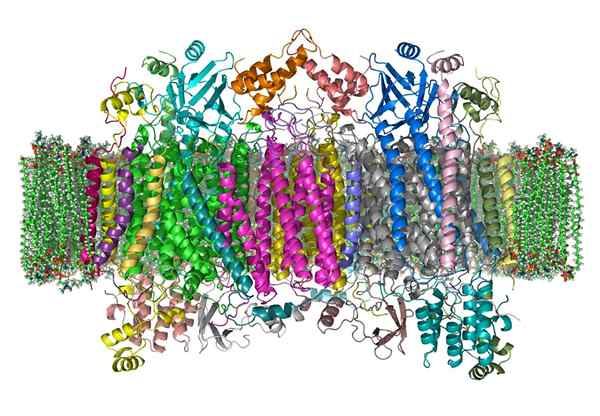 Sitokrom oksidase
Sitokrom oksidase Sitokrom oksidase adalah enzim yang berpartisipasi dalam proses mendapatkan energi, yang dilakukan dalam mitokondria dari hampir semua makhluk hidup.
Ini adalah holoenzim kompleks yang membutuhkan kolaborasi kofaktor tertentu, ion besi dan tembaga, untuk mengkatalisasi reaksi transfer elektron dan produksi ATP.
Piruvat kinase
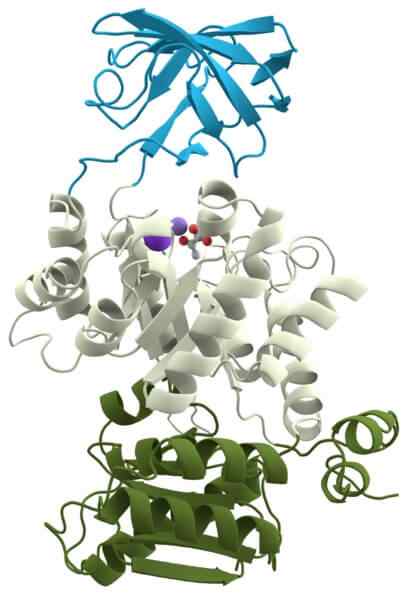 Sitokrom oksidase
Sitokrom oksidase Kinase piruvat adalah holoenzim penting lainnya untuk semua sel, karena ia berpartisipasi dalam salah satu rute metabolisme universal: glikolisis.
Fungsinya adalah untuk mengkatalisasi transfer gugus fosfat molekul yang disebut fosfoenolpyruvat ke molekul lain yang disebut adenosin difosfat, untuk membentuk ATP dan piruvat.
Supporting membutuhkan kation kalium (k ') dan magnesium (mg+2) sebagai kofaktor untuk membentuk holoenzim fungsional.
Karboksilase piruvat
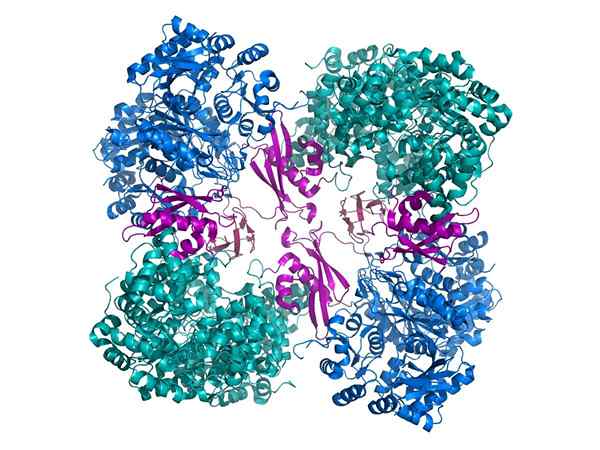 Karboksilase piruvat
Karboksilase piruvat Contoh penting lainnya adalah karboksilase piruvat, holoenzy. Dengan demikian, piruvat menjadi oksalasetat, perantara penting dalam metabolisme.
Agar aktif secara fungsional, foose -carboxylase pyravate membutuhkan kofaktor yang disebut biotin.
Asetil COA karboksilase
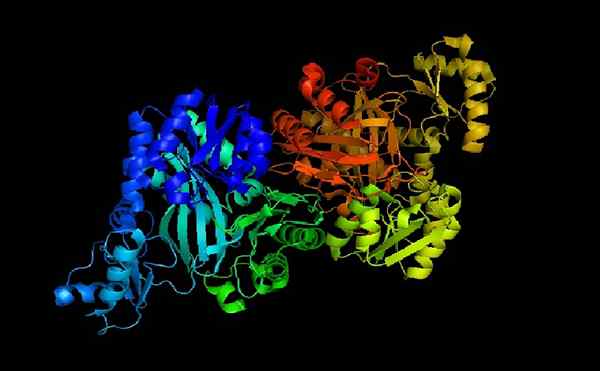 Asetil COA karboksilase e-coli
Asetil COA karboksilase e-coli Asetil-CoA carboxilase adalah holoenzim yang kofaktornya, seperti yang ditunjukkan oleh namanya, adalah koenzim untuk.
Ketika apoenzim dan koenzim A digabungkan, holoenzim secara katalitik aktif untuk melakukan fungsinya: mentransfer gugus karboksil ke asetil-KoA untuk mengubahnya menjadi koenzim malonil A (malonyl-CoA).
Dapat melayani Anda: curl: komposisi, bagian, kepentinganAcetyl-CoA melakukan fungsi penting di kedua sel hewan dan sel tanaman.
Oksidase monoamine
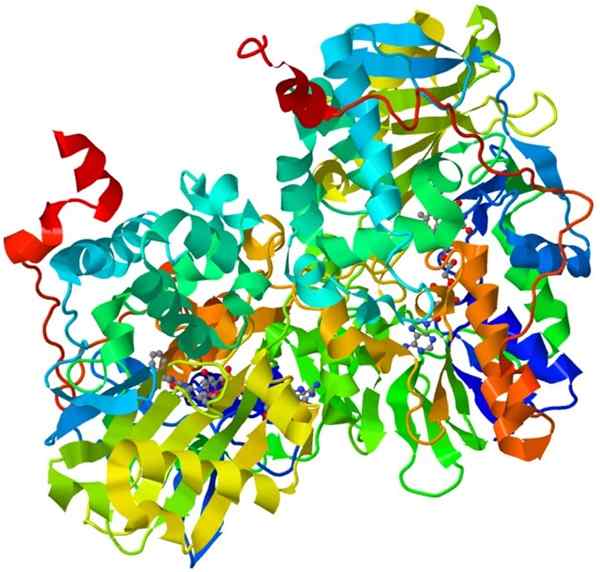 Struktur monoamina oksidase
Struktur monoamina oksidase Ini adalah holoenzim penting dalam sistem saraf manusia, fungsinya adalah untuk mempromosikan degradasi neurotransmiter tertentu.
Agar monoamine oksidase aktif secara katalitik, ia perlu secara kovalen menyatukan kofaktornya, flavin dan adenine dinucleotide (FAD).
Dehidrogenase laktat
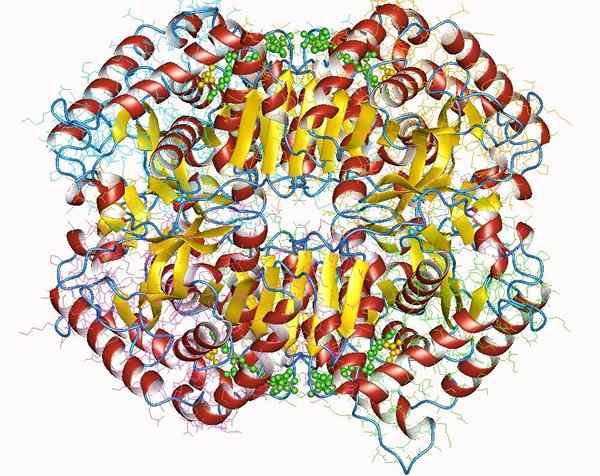 Dehidrogenase laktat
Dehidrogenase laktat Dehidrogenase laktat adalah holoenzim penting untuk semua makhluk hidup, terutama di jaringan yang mengonsumsi banyak energi, seperti jantung, otak, hati, otot rangka, paru -paru, antara lain.
Enzim ini membutuhkan keberadaan kofaktornya, nikotinamide dan adenin (NAD), untuk mengkatalisasi reaksi konversi piruvat laktat.
Katalase
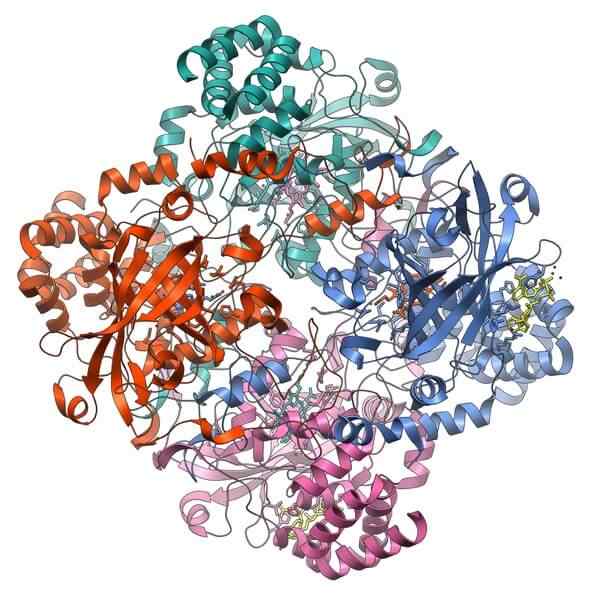 Struktur protein katalase. Sumber: Vossman, CC BY-SA 3.0, via Wikimedia Commons
Struktur protein katalase. Sumber: Vossman, CC BY-SA 3.0, via Wikimedia Commons Catalase adalah holoenzim penting dalam pencegahan toksisitas sel. Fungsinya adalah mendekomposisi hidrogen peroksida, produk metabolisme sel, oksigen dan air.
Dukungan Catalase membutuhkan dua kofaktor untuk diaktifkan: ion mangan dan kelompok prostetik hemo, mirip dengan hemoglobin.
Referensi
- Athappilly, f. K., & Hendrickson, W. KE. (sembilan belas sembilan puluh lima). Struktur domain biotinil asetil-koenzim A karboksilase yang ditentukan oleh pentahapan gila. Struktur, 3(12), 1407-1419.
- Berg, J., Tymoczko, J., Gatto, g. & Strayer, L. (2015). Biokimia (Edisi ke -8.). W. H. Freeman and Company.
- FEGLER, J. (1944). Fungsi karbonik anhidrase dalam darah. Alam, 137-38.
- Gaweska, h., & Fitzpatrick, P. F. (2011). Struktur dan mekanisme keluarga monoamine oksidase. Konsep Biomolekul, 2(5), 365-377.
- Gupta, v., & Bamezai, R. N. K. (2010). Human Pyruvate Kinase M2: Protein multifungsional. Protein sains, 19(11), 2031-2044.
- Jitrapakdee, s., St Maurice, M., Rayment, i., Cleland, w. W., Wallace, J. C., & Attwood, P. V. (2008). Struktur, mekanisme dan regulasi piruvat karboksilase. Jurnal Biokimia, 413(3), 369-387.
- Muirhead, h. (1990). Isoenzim piruvat kinase. Transaksi Masyarakat Biokimia, 18, 193-196.

