Pentingnya Tabel 8 Berkala
- 4742
- 659
- Ray Thiel
Itu Pentingnya tabel periodik Dia tidak dapat dipungkiri untuk fakta sederhana bahwa selama lebih dari seratus tahun dia telah mendukung para ilmuwan untuk memerintahkan semua elemen kimia, dan akan terus melakukannya untuk sisa keberadaan manusia. Ini adalah semacam bangunan dengan basis eksperimental dan teoretis yang merangkum sifat materi yang diketahui.
Meskipun beberapa model telah dikembangkan sebelum tabel periodik ahli kimia Rusia Dmitri Mendeleev, tujuannya selalu sama: memesan, mencari dan memprediksi elemen kimia yang berbagi sifat yang sama. Dengan demikian, posisi atau kotak tabel ini mengungkapkan lebih banyak informasi daripada yang dapat diwawancarai dengan mata telanjang.
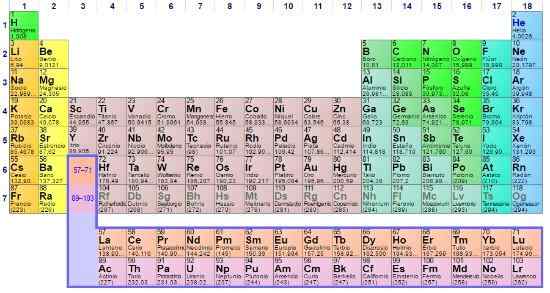
 Tabel periodik adalah ikon dan alat ilmiah di mana kimia, fisika, sejarah dan literatur bertemu
Tabel periodik adalah ikon dan alat ilmiah di mana kimia, fisika, sejarah dan literatur bertemu Tabel periodik hadir di semua tingkat pelatihan akademik, bahkan menjadi ikon pengetahuan umum. Meskipun sangat penting dalam kimia, kebenarannya adalah juga penting dalam fisika dan biologi, selain menjadi sumber studi dan inspirasi bagi pecinta sejarah dan sastra.
Itulah mengapa beberapa alasan mengapa tabel periodik itu penting.
Apa pentingnya tabel periodik?
Anda dapat memberikan alasan berbeda yang menjelaskan pentingnya alat ilmiah ini:
Ini adalah dasar kimia anorganik

Kimia anorganik praktis adalah studi tentang tabel periodik. Tanpa itu, semua pengetahuan yang dicapai di sekitar jenis materi ini akan turun. Mereka yang berdedikasi untuk cabang kimia ini, sangat penting bahwa mereka dapat membaca dan mengekstrak semua informasi yang ditawarkan tabel ini tentang elemen kimia di luar karbon dan isotopnya.
Untuk bahan kimia organik, berkali -kali melihat sisi kanan tabel periodik: lebih tepatnya menuju bagian atas blok P, dimana karbon berada dan beberapa non -logam.
Dapat melayani Anda: tritioDi sisi lain, ahli kimia anorganik harus meninjau semua logam yang membentuk blok D Dan F, serta kelompok 18 gas mulia, sehingga mereka akhirnya menjadi terbiasa dengan semua elemen kimia; Kecuali mungkin yang sintetis dan sangat radioaktif.
Menjelaskan pengetahuan kimia
Sebelum tabel periodik dan upaya pertama untuk memesan elemen kimia berdasarkan kesamaannya, kimia dibungkus dengan aura dan mistisisme yang tidak pasti.
Tidak ada yang tahu persis berapa banyak atau yang merupakan semua elemen kimia yang bisa ada di alam. Berkat tabel ini, hari ini diketahui bahwa kami memiliki maksimal 118 elemen. Apa yang tampak gelap sebelumnya, sekarang jelas, dapat dimengerti dan terorganisir.
Memungkinkan memprediksi sifat elemen baru
Pada awalnya, tabel periodik berisi ruang kosong, karena pada saat itu beberapa elemen kimia belum ditemukan.
Lokasi ruang -ruang ini menunjukkan bahwa elemen baru, sesuai dengan rekan -rekannya, harus bereaksi sama; Dan bahkan lebih lagi, itu bahkan dapat ditemukan di sumber mineral yang sama.
Dan itu sebenarnya dalam pengobatan kimia simfin mineral di mana unsur -unsur kimia yang hilang secara perlahan ditemukan; Misalnya, Gallium, Germanio dan Skandio. Gallium, berada di bawah aluminium, harus berbagi sifat dengan yang terakhir dan membentuk mineral (oksida, sulfida, klorida, dll.) tipe yang sama.
Jika elemen 119 dibuat, itu harus ditempatkan di bawah Francio, di Grup 1; dan karena itu, bereaksi atau memiliki sifat kimia yang mirip dengan logam alkali lainnya (lithium, natrium, kalium, dll.).
Dapat melayani Anda: faktor pengenceranPerbedaan dan mengklasifikasikan elemen kimia
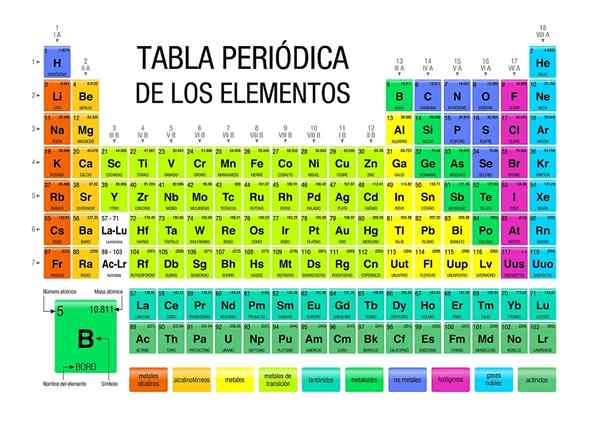
Dalam tabel periodik dimungkinkan untuk mengamati bagaimana elemen diklasifikasikan dan tersedia di bidang atau kelompok tertentu. Misalnya, non -logam berorientasi pada kanan atas.
Sementara itu, logam, yang membentuk sebagian besar elemen, mengintegrasikan sisi kiri dan tengah meja, serta blok F: Dua baris di bawah ini.
Setiap kelompok yang terdaftar dari 1 hingga 18, mendefinisikan keluarga elemen. Kelompok 1 disebut logam alkali, kelompok 2, logam alkalinotherrous, yang dari 3, kelompok skandi, dan sebagainya. Beberapa kelompok memiliki nama unik, seperti Grup 16 atau oksigen, yang disebut calcogens atau amphumos.
Simpan informasi dalam jumlah besar
Dalam tabel periodik kita dapat melihat angka oksidasi untuk setiap elemen, energi ionisasi, massa atom rata -rata, konfigurasi elektroniknya, elektronegatifitasnya, dan seluruh rangkaian sifat periodiknya.
Juga, di beberapa tabel bahkan dimungkinkan untuk menemukan informasi tentang fusi normal dan titik didihnya, serta struktur kristal padatannya. Dalam pengertian ini, tabel periodik yang lebih khusus muncul daripada yang lain, tergantung pada pekerjaan dan tingkat akademik.
Mengklarifikasi tren periodik
Mengikuti kelompok dan jajaran tabel periodik, dimungkinkan untuk secara jelas mengamati bagaimana sifat periodik berubah saat kita berpindah dari satu elemen ke elemen lainnya.
Misalnya, jari -jari atom berkurang sepanjang baris, dari kiri ke kanan, tetapi meningkat ketika kita turun oleh kelompok. Juga, karakter logam meningkat dari atas ke bawah, dan dari kanan ke kiri.
Memprediksi sifat senyawa yang terbentuk
Senyawa terbentuk ketika dua atau lebih elemen bereaksi satu sama lain. Bergantung pada posisi masing -masing dalam tabel periodik, dimungkinkan untuk memprediksi apa sifat kimia dari senyawa ini yang dimaksud.
Dapat melayani Anda: Hydrogen bromide (HBR)Misalnya, jika sodium logam dan gas klorin bereaksi, mereka akan menimbulkan natrium klorida, garam. Ini karena natrium adalah logam, sedangkan klorin A non -logam, yang perbedaannya antara elektronegatifnya besar, sehingga mendukung pembentukan senyawa ionik.
Itu adalah jendela ke sejarah sains
 Marie Curie
Marie Curie Setiap elemen memiliki sejarah dan penemu. Nama -nama mereka hanya refleks atau mereka yang menemukannya, dari wilayah geografis di mana mereka diekstraksi dalam bentuk murni, atau warna khas mineral mereka. Misalnya, gas helium berutang namanya justru karena diidentifikasi di bawah sinar matahari.
Di meja periodik kita melihat sepotong kehidupan Antoine Lavoisier, Marie Curie, Carl Willhelm Scheele, Henry Cavendish, Paul Emile Lecog, dan banyak ilmuwan lain yang berkontribusi untuk menyelesaikan meja ketika menemukan elemen kimia baru baru baru -baru ini menemukan unsur kimia kimia baru baru baru baru baru kimia baru baru baru baru baru baru baru baru baru baru baru baru baru baru yang menemukan kimia baru baru baru baru kimia baru baru baru.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Helmestine, Anne Marie, PH.D. (11 Februari 2020). Mengapa tabel periode penting? Pulih dari: thinkco.com
- Ben p. Gelas bir. (28 Mei 2019). Tabel Berkala: Ini lebih dari sekedar kimia dan fisika. Pulih dari: nist.Pemerintah
- Dennis Rouvray. (10 Januari 2019). Tabel periode adalah terobosan terpenting kimia. New Scientist Ltd. Pulih dari: newscientist.com
- Wanda Thibodeaux. (26 April 2018). Pentingnya tabel periodik. Pulih dari: ilmuwan.com

