Imunoglobulin
- 2851
- 8
- Leland Robel
 Ilustrasi imunoglobulin
Ilustrasi imunoglobulin Apa itu imunoglobulin?
Itu Imunoglobulin Mereka adalah molekul yang memproduksi limfosit B dan sel plasma yang berkolaborasi dengan pertahanan organisme. Mereka terdiri dari biomolekul glikoprotein milik sistem kekebalan tubuh. Mereka adalah salah satu protein paling berlimpah dari serum darah, setelah albumin.
Antibodi adalah nama lain yang diterima imunoglobulin, dan dianggap globulin karena perilaku mereka dalam elektroforesis serum darah yang mengandung mereka. Molekul imunoglobulin bisa sederhana atau kompleks, tergantung pada apakah presentasi Anda sebagai monomer atau terpolimerisasi.
Struktur umum imunoglobulin mirip dengan huruf "y". Ada lima jenis imunoglobulin yang memiliki perbedaan morfologis, fungsional dan lokasi dalam tubuh. Perbedaan struktural antibodi tidak dalam bentuk, tetapi dalam hal komposisinya; Setiap jenis memiliki tujuan tertentu.
Respon imun yang dipromosikan oleh imunoglobulin sangat spesifik dan merupakan mekanisme yang sangat kompleks. Stimulus untuk sekresi oleh sel diaktifkan dengan adanya agen aneh pada tubuh, seperti bakteri. Fungsi imunoglobulin akan bergabung dengan elemen aneh dan menghilangkannya.
Imunoglobulin atau antibodi dapat ada baik dalam darah maupun pada permukaan membran organ. Biomolekul ini mewakili elemen penting dalam sistem pertahanan tubuh manusia.
Struktur imunoglobulin

Struktur antibodi mengandung asam amino dan karbohidrat, oligosakarida. Kehadiran dominan asam amino, kuantitas dan distribusinya adalah apa yang menentukan struktur imunoglobulin.
Seperti protein apa pun, imunoglobulin memiliki struktur primer, sekunder, tersier dan kuaterner, menentukan penampilan khasnya.
Menanggapi jumlah asam amino yang mereka hadapi, imunoglobulin memiliki dua jenis rantai: rantai berat dan rantai cahaya. Selain itu, menurut urutan asam amino dalam strukturnya, masing -masing rantai memiliki wilayah variabel dan wilayah konstan.
Rantai berat
Rantai berat imunoglobulin sesuai dengan unit polipeptida yang terdiri dari 440 urutan asam amino.
Setiap imunoglobulin memiliki 2 rantai berat, dan masing -masing memiliki wilayah variabel dan wilayah yang konstan. Wilayah konstan memiliki 330 asam amino dan variabel 110 asam amino diurutkan.
Struktur rantai berat berbeda untuk setiap imunoglobulin. Mereka adalah total 5 jenis rantai berat yang menentukan jenis imunoglobulin.
Jenis rantai berat diidentifikasi dengan huruf -huruf Yunani γ, μ, α, ε, δ untuk IgG, IgM, IgA, IgE dan IgD imunoglobulin, masing -masing.
Wilayah konstan rantai berat ε dan μ dibentuk oleh empat domain, sedangkan yang sesuai dengan α, γ, δ memiliki tiga. Kemudian, setiap wilayah konstan akan berbeda untuk setiap jenis imunoglobulin, tetapi umum untuk imunoglobulin dari jenis yang sama.
Dapat melayani Anda: otot sternocleidohioidWilayah variabel rantai berat dibentuk oleh domain tunggal imunoglobulin. Wilayah ini memiliki urutan 110 asam amino, dan akan berbeda tergantung pada spesifisitas antibodi oleh antigen.
Dalam struktur rantai berat, angulasi atau fleksi dapat diamati - engsel - yang mewakili area fleksibel rantai.
Rantai Cahaya
Rantai cahaya imunoglobulin adalah polipeptida yang terdiri dari sekitar 220 asam amino. Ada dua jenis rantai cahaya pada manusia: kappa (κ) dan lambda (λ), yang terakhir dengan empat subtipe. Domain konstan dan variabel masing -masing memiliki urutan 110 asam amino.
Antibodi dapat memiliki dua rantai cahaya κ (κκ) atau sepasang rantai λ (λλ) tetapi tidak mungkin untuk memiliki satu dari masing -masing jenis pada waktu yang sama.
Segmen FC dan FAB
Karena setiap imunoglobulin memiliki bentuk yang mirip dengan "y" dapat dibagi menjadi dua segmen. Segmen "bawah", pangkalan, disebut fraksi yang dapat dikristalisasi atau FC; Sedangkan lengan "y" membentuk fab, atau fraksi yang menyatukan antigen. Masing -masing bagian struktural imunoglobulin ini melakukan fungsi yang berbeda.
Segmen FC
Segmen FC memiliki dua atau tiga domain konstan dari rantai berat imunoglobulin.
FC dapat bergabung dengan protein atau penerima spesifik dalam basofil, eosinofil atau sel gandum, sehingga menginduksi respon imun spesifik yang akan menghilangkan antigen. FC sesuai dengan ujung karboksil imunoglobulin.
Segmen hebat
Fraksi atau segmen FAB dari suatu antibodi berisi domain variabel di ujungnya, di samping domain konstan dari rantai berat dan ringan.
Domain konstan dari rantai berat berlanjut dengan domain segmen FC yang membentuk engsel. Itu sesuai dengan ujung amino-terminal imunoglobulin.
Pentingnya segmen FAB adalah bahwa hal itu memungkinkan penyatuan dengan antigen, zat aneh dan berpotensi berbahaya.
Domain variabel dari setiap imunoglobulin menjamin kekhususan mereka dengan antigen yang diberikan; Fitur ini bahkan memungkinkan penggunaannya dalam diagnosis penyakit radang dan menular.
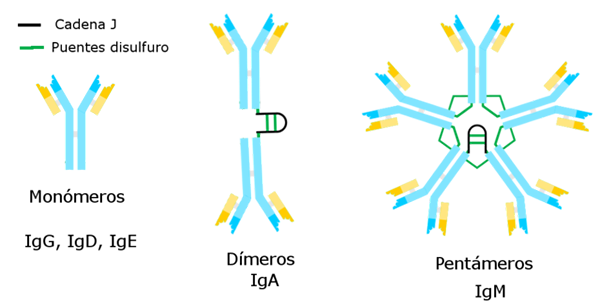
Jenis imunoglobulin
 Oleh Alejandro Porto [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)], melalui Wikimedia Commons
Oleh Alejandro Porto [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)], melalui Wikimedia Commons Imunoglobulin yang dikenal sejauh ini memiliki rantai berat spesifik yang konstan untuk masing -masing dan perbedaan dari yang lain.
Ada lima varietas rantai berat yang menentukan lima jenis imunoglobulin, yang fungsinya berbeda.
Imunoglobulin G (IgG)
Imunoglobulin G adalah varietas yang paling banyak. Ini memiliki rantai gamma yang berat dan disajikan dalam bentuk unimolekul atau monomerik.
IgG adalah yang paling berlimpah dalam serum darah dan di ruang jaringan. Perubahan minimum dalam urutan asam amino dari rantai beratnya menentukan pembagiannya menjadi subtipe: 1, 2, 3 dan 4.
Dapat melayani Anda: sarkomroImmunoglobulin G memiliki urutan 330 asam amino di segmen FC dan berat molekul 150.000, di mana 105.000 sesuai dengan rantai beratnya.
Imunoglobulin M (IgM)
Imunoglobulin M adalah Pentage yang rantai beratnya μ. Berat molekulnya tinggi, sekitar 900.000.
Urutan asam amino dari rantai beratnya adalah 440 dalam fraksi fc -nya. Ini terutama dalam serum darah, mewakili 10 hingga 12 % imunoglobulin. IgM memiliki satu subtipe.
Imunoglobulin A (IgA)
Rantai berat α sesuai dengan itu, dan mewakili 15 % dari total imunoglobulin. IgA ditemukan dalam darah dan sekresi, bahkan dalam ASI, muncul dalam bentuk monomer atau dimer. Berat molekul imunoglobulin ini adalah 320.000 dan memiliki dua subtipe: IgA1 dan IgA2.
Imunoglobulin E (IgE)
Imunoglobulin E terdiri dari tipe rantai berat ε dan sangat langka dalam serum, sekitar 0,002 %.
IgE memiliki berat molekul 200.000 dan hadir sebagai monomer terutama dalam serum, lendir hidung dan air liur. Juga umum untuk menemukan imunoglobulin ini dalam basofil dan sel mast.
Imunoglobulin D (IGD)
Variasi rantai berat δ sesuai dengan imunoglobulin D, yang mewakili 0,2 % dari total imunoglobulin. IGD memiliki berat molekul 180.000 dan disusun dalam bentuk monomer.
Ini terkait dengan limfosit B, melekat pada permukaan ini. Namun, fungsi IGD tidak jelas.
Ketik Perubahan
Imunoglobulin dapat mengalami perubahan jenis struktural, karena kebutuhan pertahanan terhadap antigen.
Perubahan ini disebabkan oleh fungsi limfosit B dari antibodi manufaktur oleh properti imunitas adaptif. Perubahan struktural berada di daerah konstan rantai berat, tanpa mengubah wilayah variabel.
Perubahan kelas atau kelas dapat menyebabkan IgM diteruskan ke IgG atau IgE, dan ini terjadi sebagai respons yang diinduksi oleh interferon gamma atau interleusin IL-4 dan IL-5.
Fungsi imunoglobulin
Peran yang dimainkan oleh imunoglobulin dalam sistem kekebalan tubuh sangat penting bagi pertahanan organisme.
Imunoglobulin adalah bagian dari sistem kekebalan humoral; yaitu, mereka adalah zat yang disekresikan oleh sel untuk perlindungan terhadap patogen atau agen berbahaya.
Mereka memberikan sarana pertahanan yang efektif, efektif, spesifik dan sistematis, karena bernilai tinggi sebagai bagian dari sistem kekebalan tubuh. Mereka memiliki fungsi umum dan spesifik dalam kekebalan:
Fungsi umum
Antibodi atau imunoglobulin memenuhi fungsi independen dan mengaktifkan respons efektor dan sekretori yang dimediasi oleh sel.
Persatuan Antigen-Cantiuerpo
Imunoglobulin memiliki fungsi bergabung dengan agen antigenik secara khusus dan selektif.
Pembentukan kompleks antigen-antibodi adalah fungsi utama dari imunoglobulin dan, oleh karena itu, adalah respons imun yang dapat menghentikan aksi antigen. Setiap antibodi dapat bergabung dengan dua atau lebih antigen secara bersamaan.
Dapat melayani Anda: tulang alveolarFungsi yang efektif
Sebagian besar waktu kompleks antigen-antibodi berfungsi sebagai awal untuk mengaktifkan respons seluler spesifik atau memulai urutan peristiwa yang menentukan penghapusan antigen. Dua respons efektor yang paling umum adalah penyatuan sel dan aktivasi komplemen.
Persatuan seluler tergantung pada keberadaan reseptor spesifik untuk segmen FC imunoglobulin, setelah bergabung dengan antigen.
Sel seperti sel mast, eosinofil, basofil limfosit dan fagosit memiliki reseptor ini dan memberikan mekanisme eliminasi antigen.
Aktivasi air terjun komplemen adalah mekanisme kompleks yang melibatkan awal urutan, sehingga hasil akhirnya adalah sekresi zat beracun yang menghilangkan antigen.
Fungsi spesifik
Pertama, setiap jenis imunoglobulin mengembangkan fungsi pertahanan tertentu:
Imunoglobulin g
- Imunoglobulin G memberikan sebagian besar pertahanan terhadap agen antigenik, termasuk bakteri dan virus.
- Mekanisme aktif IgG seperti komplemen dan fagositosis.
- Konstitusi IgG spesifik untuk antigen tahan lama.
- Satu -satunya antibodi yang dapat ditransfer ibu ke anak -anak selama kehamilan adalah IgG.
Imunoglobulin m
- IgM adalah antibodi respons cepat sebelum agen berbahaya dan menular, karena memberikan tindakan segera sampai digantikan oleh IgG.
- Antibodi ini mengaktifkan respons seluler yang dimasukkan ke dalam membran limfosit humoral dan respons seperti komplemen.
- Ini adalah imunoglobulin pertama yang mensintesis manusia.
Imunoglobulin a
- Itu bertindak sebagai penghalang pertahanan terhadap patogen, saat terletak di permukaan selaput lendir.
- Ini hadir dalam mukosa pernapasan, sistem pencernaan, saluran kemih dan juga dalam sekresi seperti air liur, lendir hidung dan air mata.
- Meskipun aktivasi komplemennya rendah, dapat dikaitkan dengan kehalusan untuk menghilangkan bakteri.
- Kehadiran imunoglobulin D baik dalam ASI maupun di caloster memungkinkan bayi baru lahir untuk mendapatkannya selama menyusui.
Imunoglobulin e
- Imunoglobulin dan memberikan mekanisme pertahanan yang kuat terhadap produsen alergi yang memproduksi.
- Interaksi IgE dan alergen akan membuat zat radang bertanggung jawab atas gejala alergi, seperti bersin, batuk, sarang, peningkatan air mata dan lendir hidung.
- IgE juga dapat digabungkan ke permukaan parasit melalui segmen FC -nya, menghasilkan reaksi yang menghasilkan kematian dari ini.
Imunoglobulin d
- Struktur monomer IGD terkait dengan limfosit B yang belum berinteraksi dengan antigen, sehingga mereka melakukan fungsi reseptor.
- Fungsi IGD tidak jelas.

