Ion Hydronio
- 2647
- 582
- Joseph Nader PhD
Apa itu ion hidronium?
Dia Ion Hydronio Ini adalah semacam beban positif yang dihasilkan dari protonasi molekul air, dan yang formula kimianya h3SALAH SATU+. Ini terdiri dari yang paling sederhana dari Oxonians: ion di mana oksigen membawa beban formal positif dan memiliki tiga ikatan kovalen.
H3SALAH SATU+ Itu adalah salah satu kation paling sederhana namun aneh yang ada. Dalam air dalam kondisi normal ia memiliki konsentrasi 1 · 10-7 M, Produk dari keseimbangan self -alization. Namun, konsentrasinya meningkat secara eksponensial saat kuat3SALAH SATU+ Mereka larut dalam air, mengasamkannya.
 Molekul ion hidronium
Molekul ion hidronium Konsentrasi atau aktivitas h3SALAH SATU+ Di dalam air ia berfungsi untuk mengukur keasaman larutan berair: pH. Semakin banyak ion3SALAH SATU+ Jerami, kurang positif akan pH, dan lebih banyak asam akan menjadi solusi yang dimaksud. Keasaman ini, di sisi lain, terletak pada ion hidrogen, h+, yang sering dikacaukan dengan ion h3SALAH SATU+.
 Formula ion atau kation hidronik
Formula ion atau kation hidronik H+ dan kemampuannya yang luar biasa untuk mentransfer antara jembatan hidrogen molekul air memungkinkan H3SALAH SATU+ terkait dalam formasi kation yang lebih kompleks; seperti kation eigen, h9SALAH SATU4+, dan kation Zundel, h5SALAH SATU2+, dan banyak lagi.
Struktur ion hidronium
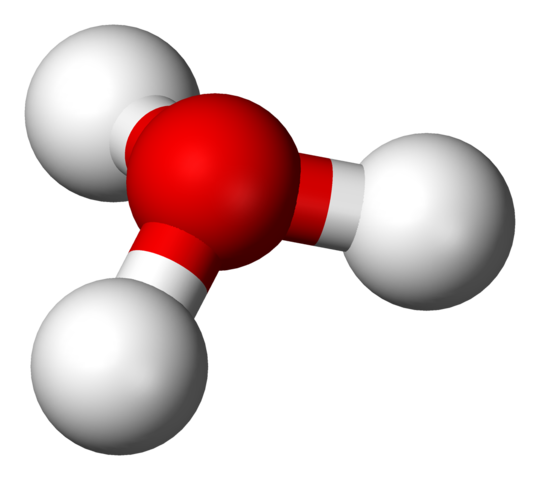 Struktur H3O+ dengan model bola dan batang
Struktur H3O+ dengan model bola dan batang Pada gambar pertama Anda bisa melihat formula struktural ion hidrium. Sekarang kita melihat representasinya dengan model bola dan bar. Dalam kedua sorotan geometri piramida trigonal, yang sudut tautannya (O-H) adalah 113º; Sedikit dialihkan dari 119º untuk tetrahedron.
Meskipun oksigen memiliki beban parsial yang positif, ini tidak berarti bahwa daerah negatif ada di sekitar atom hidrogen. Di sisi lain. Oksigen dalam h3SALAH SATU+ Ini bahkan lebih banyak produk elektronegatif dari kekurangan elektroniknya; Jadi semua kepadatan negatif divisualisasikan pada peta potensial elektrostatik:
Dapat melayani Anda: kalium sulfat (k2so4): struktur, sifat, penggunaan, sintesis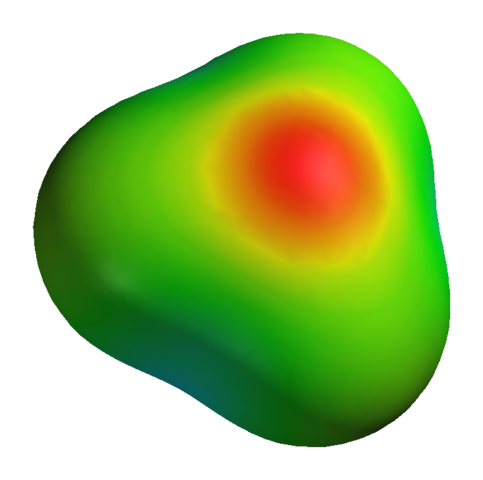 Peta potensial elektrostatik untuk H3O+
Peta potensial elektrostatik untuk H3O+ Belum lagi oksigen memiliki beberapa elektron bebas, yang memperkuat kepadatan negatif bahkan lebih.
Konsekuensi dari semua hal di atas adalah Hidrogen H3SALAH SATU+ Mereka kehilangan kepadatan elektronik, karena oksigen menariknya ke arah dirinya sendiri. Oleh karena itu, h3SALAH SATU+ Anda dapat membangun sumber hidrogen yang sangat kuat dengan molekul air tetangga: h2SALAH SATU+-H-oh2.
Interaksi ini adalah kunci di balik mobilitas ionik yang menakjubkan dari H+ dan mengapa h3SALAH SATU+ Itu mampu bergaul dengan banyak molekul air secara bersamaan.
Keasaman
Ion hidroni adalah asam yang sangat kuat. Faktanya, itu adalah asam terkuat yang bisa ada dalam larutan berair. Karena? Karena asam lain yang lebih kuat darinya akan memprotonasi molekul air untuk berasal dari H3SALAH SATU+:
Ha + h2O → a- + H3SALAH SATU+
H3SALAH SATU+ Itu mampu tetap stabil kapan pun tidak ada basis lain di lingkungan yang lebih kuat dari air. Asam apa pun telah memenuhi ini akan diklasifikasikan sebagai asam yang kuat. Sementara itu, jika asam lebih lemah dari h3SALAH SATU+, Maka bagian dari HA tidak akan sepenuhnya dipisahkan dan kita akan berbicara tentang asam lemah:
Ha + h2Atau ⇌ a- + H3SALAH SATU+
Oleh karena itu, karena h3SALAH SATU+ Itu adalah asam terkuat yang ada di dalam air, keasamannya akan tergantung pada konsentrasi h3SALAH SATU+. Ini adalah dasar untuk mendefinisikan, secara sederhana, keasaman larutan berair yang dinyatakan sebagai pH:
pH = -log [h3SALAH SATU+]
H+ Vs. H3SALAH SATU+
Ion hidrogen dan hidronium tidak sama. H+ Itu jauh lebih asam daripada h3SALAH SATU+, Nah, itu terdiri dari proton tidak lebih, yang akan mencari molekul untuk mendapatkan elektron dengan segala cara. Kapan h+ Dapatkan bentuk molekul air h3SALAH SATU+:
Itu bisa melayani Anda: cupric oxide (cuo)H+ + H2O → h3SALAH SATU+
Itulah mengapa h3SALAH SATU+ dapat diwakili sebagai h+(Ac), menunjukkan bahwa itu adalah h+ Dalam media berair.
Kekuatan asam diukur dalam kemampuannya untuk menyumbang, sesuai dengan definisi Ion Brönsted-Lowry, H+. Seberapa kuatnya itu, semakin disumbangkan+, Tidak h3SALAH SATU+. Asam terkuat yang pernah disintesis (supercids) adalah di mana h+ Dia "telanjang"; yaitu, tanpa hambatan untuk melompat ke arah molekul yang akan memprotonasi.
Praktik mewakili h3SALAH SATU+ abu+(AC) Sangat umum sehingga ada banyak kali berbicara tentang keduanya seolah -olah mereka sama, tanpa itu berdampak negatif pada interpretasi kimia solusi.
Pelarut
H3SALAH SATU+ Itu dapat membentuk jembatan hidrogen yang sangat kuat dengan molekul air tetangga. Dengan melakukan itu, kami memiliki kation zundel, h5SALAH SATU2+:
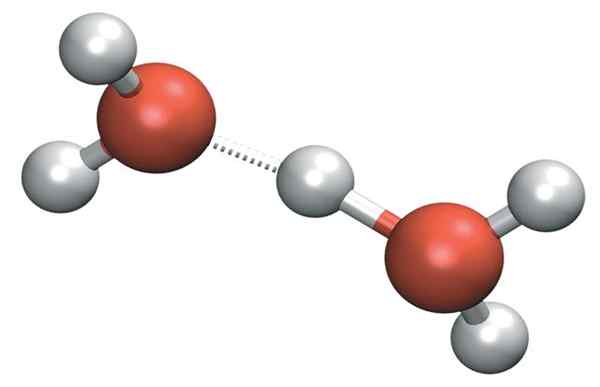 Kation zundel
Kation zundel Tetapi beban positif tidak hanya tetap pada satu sisi kation: ini dapat ditransfer ke molekul air lainnya seperti ion h+:
H2Oh-+Oh2 → H2SALAH SATU+-H- Oh2
Oleh karena itu, beban positif didistribusikan antara kedua atom oksigen untuk dua molekul air.
Dalam kasus kation eigen, h9SALAH SATU4+, an h3SALAH SATU+ Bentuk jembatan hidrogen dengan tiga molekul air, mendistribusikannya beban positif berkat "lompatan" h+. Lompatan ini sangat cepat, sehingga mereka menjelaskan mobilitas ionik besar h+ Di air, menggunakan h3SALAH SATU+ Sebagai kendaraan, dan molekul air seperti jalan raya.
H5SALAH SATU2+ dan H9SALAH SATU4+ Mereka bukan satu -satunya asosiasi kationik yang h3SALAH SATU+ bisa berasal dari air. Beberapa perhitungan dinamika molekuler menunjukkan keberadaan kluster H3SALAH SATU+(H2SALAH SATU)dua puluh: 20 jam molekul2Atau berinteraksi dengan kation3SALAH SATU+ dan mendistribusikan di antara mereka beban positif.
Dapat melayani Anda: neodymium: struktur, sifat, penggunaanOleh karena itu, h3SALAH SATU+ dan H+ Mereka membangun hubungan yang aneh dengan molekul air, di luar keasaman.
Kamu keluar
Seperti halnya kamar oksy organik, tidak terkecuali dengan oksi yang berasal dari protonasi air. Formula umumnya adalah [h3SALAH SATU+] [X-], Di mana x- Ini adalah anion yang berasal dari pembubaran asam yang sangat kuat.
Garam -garam ini terkadang menerima nama 'asam monohidrat', karena formula [h3SALAH SATU+] [X-] atau h3SALAH SATU+· X- Itu juga dapat ditulis sebagai hx · h2SALAH SATU. Dengan demikian, mungkin ada asam dihidrat, hx · 2h2Atau, trihidrat, hx · 3h2Atau, dll.
Misalnya, HCl dapat mengkristal sebagai HCl · h2OH3SALAH SATU+· Cl-. Kami juga memiliki garam hidronium lainnya seperti h3SALAH SATU+· Clo4- atau hclo4· H2Atau, dan hbr · 4h2OH3SALAH SATU+· Br-· 3H2SALAH SATU.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia InorgánICA. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2020). Hidronium. Diperoleh dari: di.Wikipedia.org
- Avneet Kahlon & Stephen Lower. (15 Agustus 2020). Ion hidronium. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (25 Agustus 2020). Definisi ion hidronium. Pulih dari: thinkco.com
- Para editor Eeritlopaedia Britannica. (2020). Ion hidrogen. Dipulihkan dari: Britannica.com

