Karakteristik Laminina, Struktur, Fungsi, Jenis
- 3956
- 852
- Herbert Fritsch
Itu Laminin Ini adalah salah satu protein yang merupakan matriks ekstraseluler dari membran basal jaringan epitel pada hewan vertebrata. Jenis protein ini memberikan dukungan pengikatan antara sel -sel jaringan konjungtif, sehingga mereka bekerja dalam kohesi dan pemadatannya.
Secara umum, laminin bertanggung jawab untuk memesan jaringan protein rumit yang membentuk matriks ekstraseluler atau membran jaringan basal. Biasanya laminin dikaitkan dengan protein seperti kolagen, proteoglikan, entaktin dan hepar akan sulfat.
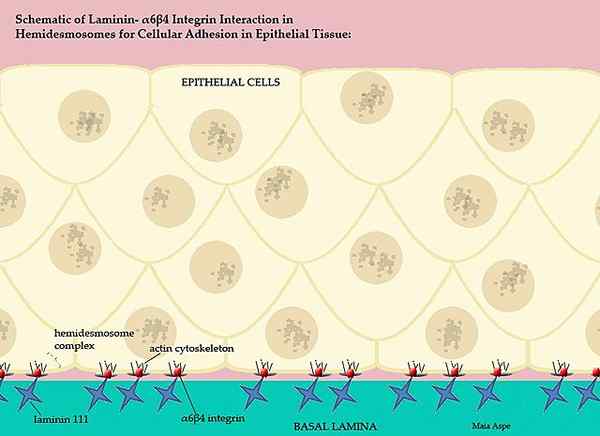
 Laminin dan partisipasi mereka dalam membran vertebrata basal (Sumber: MaiaApe/CC BYS-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0) Via Wikimedia Commons)
Laminin dan partisipasi mereka dalam membran vertebrata basal (Sumber: MaiaApe/CC BYS-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0) Via Wikimedia Commons) Membran basal yang rumit ini, diperintahkan oleh laminin, memisahkan bagian epitel jaringan, yaitu, masing -masing matriks ekstraseluler memisahkan endotelium dari mesototio dan matriks ekstraseluler dari mesotelito memisahkan lapisan dari epitelium ini dari lapisan epithelium dari epitel.
Banyak investigasi telah menunjukkan bahwa ekspresi gen laminin bermutasi berpotensi mematikan sel, karena ini juga bertanggung jawab untuk mengatur hampir semua interaksi kompleks yang terjadi dalam membran basal.
Ada keragaman besar keluarga laminin di semua vertebrata. Ini bervariasi dalam komposisi, bentuk, fungsi dan asal. Pada individu yang sama, dalam jaringan yang berbeda, laminin yang berbeda dapat ditemukan, masing -masing beradaptasi dengan lingkungan jaringan yang mengekspresikannya.
[TOC]
Karakteristik laminina
Monomer atau unit laminin terdiri dari heterotromer rantai glikoprotein yang berbeda. Protein ini mengandung banyak domain yang berbeda (multidominium) dan merupakan bagian penting dari perkembangan embrionik awal jaringan.
Bentuk umum laminin adalah sejenis "salib" atau "y", meskipun beberapa memiliki bentuk bar panjang dengan empat konsekuensi. Variasi kecil ini memungkinkan setiap jenis laminin reguler integrasi yang memadai dari posisi apa pun di jaringan.
Itu dapat melayani Anda: p-nitrofenol: karakteristik, penggunaan dan toksisitasLaminin memiliki berat molekul tinggi, yang dapat bervariasi tergantung pada jenis laminin, dari 140 hingga 1000 kDa.
Secara umum, setiap membran basal memiliki satu atau beberapa jenis laminin di dalamnya dan beberapa ilmuwan mengusulkan bahwa laminin menentukan sebagian besar fungsi fisiologis dari membran basal jaringan di mana mereka ditemukan.
Pada hewan vertebrata, setidaknya 15 jenis laminin yang berbeda telah ditemukan, diklasifikasikan dalam keluarga, karena mereka dibentuk dari pemangkas yang sama, tetapi dengan kombinasi yang berbeda. Pada hewan invertebrata mereka telah menemukan antara 1 dan 2 trimer yang berbeda.
Studi saat ini menunjukkan bahwa laminin semua hewan vertebrata muncul melalui diferensiasi ahli ortologi, yaitu, semua gen yang mengkode laminin memiliki asal yang sama dari hewan invertebrata.
Struktur
Meskipun sejumlah besar fungsi yang mengatur laminin, mereka memiliki struktur yang cukup sederhana yang, sebagian besar, diawetkan di antara berbagai jenis yang diketahui.
Setiap laminin terdiri dari tiga rantai berbeda yang saling terkait satu sama lain membentuk semacam "serat terjalin". Masing -masing dari tiga rantai diidentifikasi sebagai ALFA (α), beta (β) dan gamma (γ).
Pembentukan trimer masing-masing laminin tergantung pada penyatuan wilayah terminal-C dari masing-masing rantai. Di dalam setiap molekul, rantai ini dipasangkan melalui tautan peptida dan tiga jembatan disulfida yang memberi struktur resistensi mekanik yang besar.
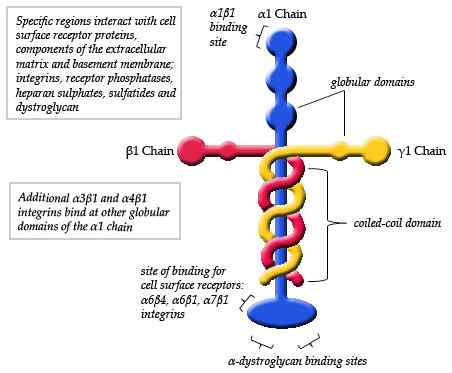 Diagram skematik dari struktur laminin (sumber: maiaaspe/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/3.0) Via Wikimedia Commons)
Diagram skematik dari struktur laminin (sumber: maiaaspe/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/3.0) Via Wikimedia Commons) Pengamatan yang dilakukan oleh mikroskop elektronik dari monomer laminin khas telah merinci bahwa struktur adalah sejenis salib asimetris yang memiliki lengan panjang sekitar 77 nm (nanometer) yang ditandai dengan bentuk globular yang menonjol di salah satu ujungnya.
Dapat melayani Anda: dinamika populasiSelain itu, tiga lengan pendek diamati, dua dari sekitar 34 nm dan satu dari sekitar 48 nm. Setiap lengan berakhir pada satu ujung globular, mirip dengan rantai utama, tetapi ukurannya lebih kecil.
Perbedaan antara berbagai jenis laminin terutama disebabkan oleh perbedaan rantai α, yang dapat dilipat setidaknya dalam tiga cara berbeda; Meskipun saat ini variasi untuk semua rantai telah diidentifikasi:
- 5 variasi atau rantai laminin α yang berbeda
- 3 variasi rantai β
- 3 variasi untuk rantai γ
Fungsi
Fungsi laminin yang paling penting dan umum dipelajari adalah interaksi dengan reseptor yang berlabuh di membran sel sel yang berdekatan dengan membran basal di mana ini ditemukan.
Interaksi ini membuat protein ini terlibat dalam regulasi beberapa aktivitas seluler dan rute pensinyalan. Karena disebutkan bahwa fungsinya bergantung pada interaksi mereka dengan reseptor spesifik pada permukaan sel (banyak reseptor membran saat ini diklasifikasikan sesuai dengan kemampuan mereka untuk menyatu dengan laminin).
Integrin adalah reseptor yang berinteraksi dengan laminin dan reseptor "non -integrin" adalah mereka yang tidak memiliki kemampuan untuk bergabung dengan protein ini. Sebagian besar reseptor "non -integrin" adalah proteoglycans, beberapa distroglikan atau syndecanos.
Pematangan jaringan organ tubuh terjadi dengan penggantian laminin awal, yang awalnya bertempat di membran basal jaringan yang membentuk organ pemuda.
Dalam laminin jenis yang paling banyak dipelajari adalah laminin-1, yang secara langsung terkait dengan pertumbuhan akson dari hampir semua jenis neuron dalam kondisi In vitro, Karena mereka mengatur pergerakan "kerucut pertumbuhan" di permukaan neuron.
Dapat melayani Anda: kaldu urea: apa itu, fondasi, persiapan, penggunaanNomenklatur dan tipe
Biokimia menganggap keluarga laminin sebagai keluarga protein yang sangat besar, di mana beberapa anggotanya masih diketahui. Namun, alat modern akan memungkinkan jenis laminin baru dilirik.
Protein semacam itu diidentifikasi masing-masing dengan angka, dimulai dengan 1 mengakhiri penomoran dalam 15 (laminin-1, laminin-2 ... laminina-15).
Jenis nomenklatur lain juga digunakan, yang menunjukkan jenis rantai mana yang dimiliki masing -masing laminin. Sebagai contoh, laminin -11 terdiri dari rantai ALFA (α) -5, dengan rantai beta (β) -2 dan oleh rantai gamma (γ) -1, sehingga dapat dinamai Laminina -521.
Selain itu, setiap laminin diklasifikasikan sesuai dengan fungsi yang terkait dengannya terkait dan juga sesuai dengan jaringan tubuh tertentu di mana ia berpartisipasi. Beberapa contoh laminin adalah:
- Lamina-1: yang berpartisipasi dalam pengembangan epitel
- Laminina-2: Terlibat dalam pengembangan miogenik semua jaringan, sistem saraf perifer dan matriks glomerulus.
- LAMINA-3: Berpartisipasi dalam serikat saya-tendinous saya
- Lamina-4: Bekerja dalam serikat neuromuskuler dan dalam matriks mesangial glomeruli
- Laminina-5, 6 dan 7: Mereka bertindak lebih disukai di jaringan epidermis.
Referensi
- Penambang, J. H., & Yurchenco, p. D. (2004). Fungsi laminin dalam morfogenesis jaringan. Annu. Putaran. Dev sel. Biol., 20, 255-284.
- Rasmussen, d. G. K., & Karsdal, m. KE. (2016). Laminin. Dalam biokimia kolagen, laminin dan elastin (pp. 163-196). Pers Akademik.
- Sasaki, t., Fässler, r., & Hohenester, dan. (2004). Laminin: Inti dari perakitan membran basement. The Journal of Cell Biology, 164 (7), 959-963.
- Timpl, r., Engel, J., & Martin, G. R. (1983). Protein laminin-A multifungsi dari membran basement. Tren Ilmu Biokimia, 8 (6), 207-209.
- Timpl, r., Rohde, h., Robey, hlm. G., Rennard, s. yo., Foidart, j. M., & Martin, G. R. (1979). Laminin-A glikoprotein dari membran basement. Jurnal Kimia Biologi, 254 (19), 9933-9937.
- Tryggvason, k. (1993). Keluarga Laminin. Opini Saat Ini dalam Biologi Sel, 5 (5), 877-882.

