Fungsi LDH, penentuan, reaksi, nilai normal
- 952
- 105
- Ray Thiel
Itu dehidrogenase laktat, Dehidrogenase asam laktat, laktat bergantung pada NAD-dependent atau hanya LDH, adalah enzim yang termasuk dalam kelompok oksidorticas yang ditemukan secara praktis di semua jaringan hewan, sayuran dan dalam banyak mikroorganisme seperti bakteri, ragi dan lengkungan.
Enzim jenis ini dilambangkan dengan angka EC 1.1.1.27 Komite Nomenklatur Enzimatik dan bertanggung jawab atas reaksi yang mengubah laktat menjadi piruvat (dengan oksidasi) dan sebaliknya (dengan reduksi), mengoksidasi atau mengurangi dyukleotida adenin nikotinamida (NAD+ dan NADH) dalam proses yang dikenal sebagai fermentasi laktik (NAD+ dan NADH) dalam proses yang dikenal sebagai fermentasi laktik (.
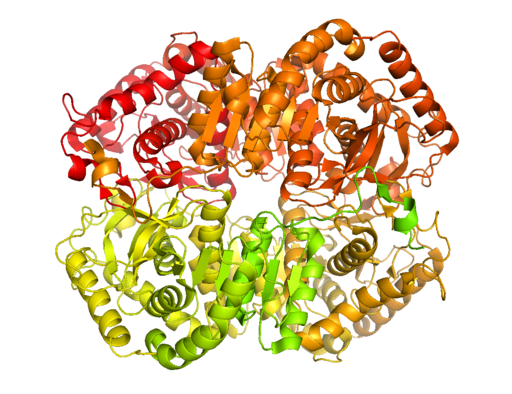
 Struktur kristal laktat dehidrogenase B (Sumber: BCDOYE [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] via Wikimedia Commons)
Struktur kristal laktat dehidrogenase B (Sumber: BCDOYE [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] via Wikimedia Commons) Tidak seperti fermentasi alkoholik, yang hanya terjadi pada beberapa mikroorganisme seperti ragi dan penggunaan.
Enzim penting untuk metabolisme sel ini dikristalisasi dari otot tikus kerangka pada tahun 1940 -an dan, hingga saat ini, yang paling ditandai adalah otot kerangka dan jaringan jantung pada mamalia.
Pada hewan "superior" enzim menggunakan isomer l laktat (L-laktat) untuk produksi piruvat, tetapi beberapa hewan dan bakteri "lebih rendah" menghasilkan D-laktat dari piruvat yang diperoleh dengan glikolisis.
Dehidrogenase laktat biasanya diekspresikan sebagian besar dalam jaringan atau sel dalam kondisi anaerob (irigasi darah rendah) yang, pada manusia, misalnya, dapat mengkarakterisasi kondisi patologis seperti kanker, kondisi hati atau jantung jantung.
Namun, konversi piruvat menjadi laktat adalah khas otot selama latihan dan kornea mata, yang kurang teroksigenasi.
[TOC]
Fungsi
Dehidrogenase laktat memenuhi banyak fungsi di berbagai rute metabolisme. Ini adalah pusat keseimbangan halus antara rute katabolik dan anabolik karbohidrat.
Selama glikolisis aerobik, piruvat (produk terakhir dari rute sendiri) Ini dapat digunakan sebagai substrat dari dehidrogenase piruvat kompleks enzimatik, oleh siapa ia didekarboksilasi, membebaskan molekul asetil-CoA yang digunakan di hilir, secara metabolik, dalam siklus Krebs.
Pada glikolisis anaerob, sebaliknya, langkah terakhir glikolisis menghasilkan piruvat, tetapi ini digunakan oleh laktat dehidrogenase untuk menghasilkan laktat dan NAD+, yang mengembalikan NAD+ yang digunakan selama reaksi yang dikatalisis oleh gliseraldehida 3-fosfat dehidrogenase.
Seperti selama anaerobiosis, sumber utama produksi energi dalam bentuk ATP adalah glikolisis, laktat dehidrogenase memiliki peran mendasar dalam reoksidasi NADH yang diproduksi dalam langkah -langkah sebelumnya dari rute glikolitik, penting untuk pengoperasian enzim terkait lainnya lainnya terkait enzim terkait lainnya terkait lainnya terkait dengan enzim terkait lainnya lainnya terkait dengan enzim terkait lainnya terkait lainnya terkait enzim terkait lainnya lainnya terkait dengan enzim terkait lainnya lainnya terkait dengan enzim terkait lainnya lainnya terkait dengan enzim terkait lainnya.
Dapat melayani Anda: tubulinDehidrogenase laktat juga terlibat dalam glikogenesis yang terjadi di jaringan yang mengubah laktat menjadi glikogen dan, dalam beberapa jaringan aerob seperti jantung, laktat adalah bahan bakar yang direoksel untuk menghasilkan energi dan mengurangi daya dalam bentuk ATP dan NAD+, masing -masing.
Karakteristik dan Struktur
Ada beberapa bentuk molekul laktat dehidrogenase di alam. Hanya pada hewan, telah ditentukan bahwa ada lima kegiatan laktat dehidrogenase, semua tetramerik dan pada dasarnya terdiri dari dua jenis rantai polipeptida yang dikenal sebagai subunitas H dan M (mampu menjadi homo atau heterotramérica).
Bentuk H biasanya pada kain jantung, sedangkan bentuk M telah terdeteksi pada otot rangka. Kedua rantai berbeda satu sama lain dalam hal kelimpahan, komposisi asam amino, sifat kinetik dan sifat struktural.
Bentuk h dan m adalah produk translasi dari gen yang berbeda, mungkin terletak di kromosom yang berbeda, dan yang juga berada di bawah kendali atau regulasi gen yang berbeda. Bentuk H lebih dominan dalam jaringan dengan metabolisme aerobik dan bentuk M dalam jaringan anaerobik.
Jenis nomenklatur lain menggunakan huruf A, B dan C untuk berbagai jenis enzim pada mamalia dan burung. Dengan demikian, laktat otot dehidrogenase dikenal sebagai4, jantung sebagai b4 dan yang ketiga disebut c4, yang spesifik untuk testis.
Ekspresi isoenzim ini diatur baik dalam bentuk pengembangan yang bergantung dan bergantung pada jaringan.
Enzim telah diisolasi dari sumber hewan yang berbeda dan telah ditentukan bahwa struktur tetrameriknya memiliki berat molekul rata -rata sekitar 140 kDa dan bahwa situs serikat untuk NADH atau NAD+ Ini terdiri dari lembar berpelap β yang terdiri dari enam rantai dan 4 baling-baling alfa.
Tekad
Oleh spektrofotometri
Aktivitas laktat dehidrogenase asal hewan adalah spektrofotometri tertentu In vitro Melalui pengukuran perubahan warna berkat proses oksidorreduksi yang terjadi selama reaksi konversi piruvat laktat.
Pengukuran dilakukan pada 340nm dengan spektrofotometer dan laju penurunan kepadatan optik karena oksidasi atau "hilangnya" NADH ditentukan, yang dikonversi menjadi NAD+.
Artinya, reaksi yang ditentukan adalah sebagai berikut:
Piruvat + nadh + h+ → laktat + nad+
Pengukuran enzimatik harus dilakukan dalam kondisi pH yang optimal dan konsentrasi substrat untuk enzim, sehingga risiko meremehkan jumlah yang ada dalam sampel karena defisit substrat atau dengan kondisi keasaman atau kebasaan ekstrem tidak berjalan.
Oleh imunohistokimia
Metode lain, mungkin agak lebih modern, untuk penentuan keberadaan dehidrogenase laktat berkaitan dengan penggunaan alat imunologis, yaitu, dengan penggunaan antibodi.
Dapat melayani Anda: homologi (biologi)Metode -metode ini memanfaatkan afinitas antara penyatuan antigen dengan antibodi yang dihasilkan secara khusus terhadapnya dan sangat berguna untuk penentuan cepat ada atau tidak adanya enzim seperti LDH dalam kain tertentu.
Tergantung pada tujuannya, antibodi yang digunakan harus spesifik untuk mendeteksi salah satu isoenzim atau untuk protein apa pun dengan aktivitas laktat dehidrogenase.
Mengapa menentukan laktat dehidrogenase?
Penentuan enzim ini dilakukan dengan tujuan yang berbeda, tetapi terutama untuk diagnosis klinis dari beberapa kondisi, termasuk infark miokard dan kanker.
Pada tingkat sel, pelepasan dehidrogenase laktat telah dianggap sebagai salah satu parameter untuk menentukan terjadinya proses nekrotik atau apoptosis, karena membran plasma menjadi permeabel.
Produk reaksi yang dikatalisasikan juga dapat ditentukan dalam kain untuk menentukan apakah metabolisme anaerob mendominasi karena beberapa alasan khusus.
Reaksi
Seperti yang awalnya dikomentari, enzim laktat dehidrogenase, yang nama sistematisnya (S) -Lactato: nad+ Dehydrogenase, Catalyz laktat konversi menjadi piruvat+ tergantung, atau sebaliknya, yang terjadi berkat transfer ion hidrida (h-) Dari piruvat ke laktat atau dari nadh ke piruvat teroksidasi.
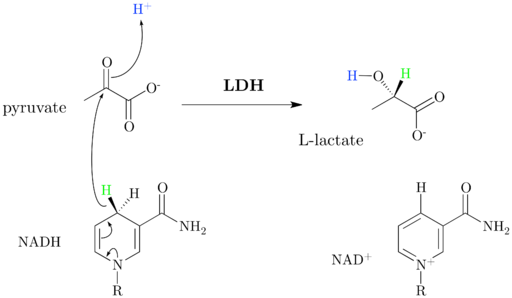 Skema dan mekanisme reaksi dehidrogenase laktat (Sumber: Jazzlw [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] via Wikimedia Commons)
Skema dan mekanisme reaksi dehidrogenase laktat (Sumber: Jazzlw [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] via Wikimedia Commons) NAD+ Ini memiliki unit ADP dan kelompok nukleotik lain yang berasal dari asam nikotinat, juga disebut niasin atau vitamin B3, Dan koenzim ini berpartisipasi dalam berbagai reaksi yang sangat penting bagi biologis.
Penting untuk menyoroti bahwa keseimbangan dalam reaksi ini dipindahkan ke samping yang sesuai dengan laktat dan telah ditunjukkan bahwa enzim juga mampu mengoksidasi asam lain (S) -2 -hydroximonocarboxylic dan penggunaan, meskipun kurang efisien, NADP+ sebagai substrat.
Bergantung pada wilayah tubuh yang dipertimbangkan dan, pada saat yang sama, karakteristik metaboliknya dalam kaitannya dengan ada atau tidak adanya oksigen, jaringan menghasilkan jumlah laktat yang berbeda, produk reaksi yang dikatalisis oleh LDH.
Jika, misalnya, sel darah merah (eritrosit) yang tidak memiliki mitokondria yang dapat memetabolisme piruvat yang diproduksi selama glikolisis menjadi co2 Dan air, maka dapat dikatakan bahwa ini adalah sel penghasil laktat utama dalam tubuh manusia, karena semua piruvat dikonversi menjadi laktat dengan aksi dehidrogenase laktat.
Di sisi lain, jika sel hati dan sel -sel otot rangka dipertimbangkan, ini bertanggung jawab untuk produksi jumlah minimum laktat, mengingat fakta bahwa ini dengan cepat dimetabolisme.
Dapat melayani Anda: Sabouraud agar: apa itu, fondasi, persiapan, penggunaanNilai normal
Konsentrasi laktat dehidrogenase dalam serum darah adalah produk dari ekspresi beberapa isoenzim di hati, jantung, otot rangka, eritrosit, dan tumor, antara lain.
Dalam serum darah, rentang normal aktivitas laktat dehidrogenase adalah antara 260 dan 850 U/mL (unit per mililiter), dengan nilai rata -rata 470 ± 130 U/mL. Sementara itu, yang hemoralisir darah memiliki aktivitas LDH yang bervariasi antara 16.000 dan 67.000 u/ml, yang setara dengan rata -rata 34.000 ± 12.000 u/ml.
Apa artinya memiliki LDH tinggi?
Kuantifikasi konsentrasi dehidrogenase laktat dalam serum darah memiliki nilai penting dalam diagnosis beberapa jantung, hati, penyakit darah dan bahkan kanker.
Angka aktivitas LDH yang tinggi telah ditemukan pada pasien dengan infark miokard (baik eksperimental dan klinis), serta pada pasien kanker, khususnya pada wanita dengan kanker endometrium, ovarium, payudara dan uterus.
Bergantung pada isoenzim tertentu yang ada dalam "kelebihan" atau dalam konsentrasi tinggi, kuantifikasi isoenzim laktat dehidrogenase digunakan oleh banyak dokter yang merawat untuk penentuan cedera pada jaringan (serius atau kronis).
Referensi
- Bergmeyer, h., Bent, e., & Hess, b. (1961). Dehidrogenase laktat. Metode analisis enzimatik. Seelag Chemie, Gmbh.
- Chung, f., Tsujubo, h., Bhattacharyya, u., Sharief, f., & Li, s. (1985). Organisasi Genomik Gen Dehidrogenase-A Laktat Manusia. Jurnal Biokimia, 231, 537-541.
- Becker, d. (2003). Asidosis laktat. Med Perawatan Intensif, 29, 699-702.
- Bahkan, j., & Kaplan, n. (1973). Dehidrogen laktat: struktur dan fungsi. Di dalam Kemajuan dalam Enzimologi dan Bidang Terkait Biologi Molekuler (hal. 61-133).
- Rubah, s. yo. (2006). Fisiologi Manusia (Edisi ke -9.). New York, AS: Press McGraw-Hill.
- Huijgen, h., Sanders, g. T. B., Koster, r. W., Vreeken, J., & Bossuyt, p. M. M. (1997). Nilai klinis dehidrogenase laktat dalam serum: tinjauan kuantitatif. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Komite Nomenklatur Uni Internasional Biokimia dan Biologi Molekuler (NC-IBMB). (2019). Diperoleh dari www.Qmul.Ac.UK/SBCS/IUBMB/ENZYME/INDEX.Html
- Rawn, J. D. (1998). Biokimia. Burlington, Massachusetts: Penerbit Neil Patterson.
- Usategui-gomez, m., Wicks, r. W., & Warshaw, m. (1979). Penentuan imunokimia isoenzim jantung laktat dehidrogenase (LDH1) dalam serum manusia. Clin Chem, 25(5), 729-734.
- Wróblewski, f., & Ladue, J. S. (1955). Aktivitas degydrogenase laktat dalam darah. Biologi dan Kedokteran Eksperimental, 90, 210-215.
- « Karakteristik Páramo, Jenis, Flora, Fauna, Contoh
- Apolipoprotein dan karakteristik, fungsi, penyakit »

