Hukum Avogadro
- 4535
- 790
- Frederick Pfeffer
Apa itu Hukum Avogadro?
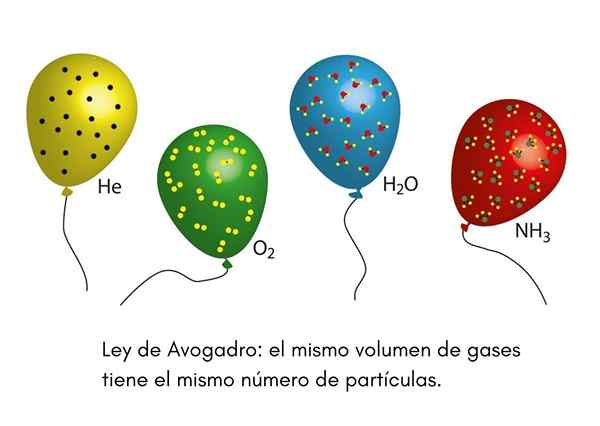
Itu Hukum Avogadro, Juga disebut Prinsip Avogadro, itu adalah undang -undang yang berlaku untuk gas ideal dan diucapkan oleh seorang ilmuwan abad ke -19 bernama Amadeo Avogadro. Undang -undang ini menetapkan bahwa dua volume yang sama dari gas yang berbeda yang berada dalam kondisi suhu dan tekanan yang sama, akan mengandung jumlah partikel gas yang sama.
Ini berarti bahwa, jika kita memiliki dua balon, satu penuh dengan helium dan yang lainnya dengan oksigen, dan kedua balon memiliki volume yang sama, tekanan yang sama dan suhu yang sama, maka akan ada jumlah atom helium gas yang sama di pertama globe molekul oksigen itu di yang kedua.
Formula Hukum Avogadro
Cara lain untuk menyatakan hukum Avogadro adalah dengan mengatakan bahwa, jika tekanan dan suhu konstan dipertahankan, volume gas akan sebanding dengan jumlah tahi lalat. Ini diwakili dengan cara matematika sebagai:
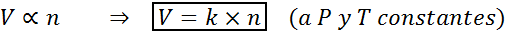
Formula ini dapat diatur ulang ke V/N = K, yaitu, bahwa hubungan antara volume dan jumlah mol tetap konstan setiap kali P dan T konstan.
Jadi, jika kami memperkenalkan atau menghapus sejumlah gas dari wadah yang menjaga konstanta P dan T, volume akan berubah dan keadaan awal dan akhir akan terkait melalui persamaan berikut:

Kondisi di mana hukum Avogadro terpenuhi
Undang -undang ini berlaku persis untuk gas ideal. Ini adalah gas yang dibentuk oleh partikel spesifik (yang tidak menempati volume dalam ruang) yang tidak berinteraksi satu sama lain dengan cara apa pun.
Itu dapat melayani Anda: biodiesel: riwayat, properti, jenis, keuntungan, kerugianSeperti namanya, jenis gase ini tidak ada dalam kenyataan tetapi dalam imajinasi kita. Mereka adalah "ide" yang disederhanakan dari apa yang kami yakini adalah gas. Namun, ada beberapa kondisi di mana gas asli, seperti udara, berperilaku idealnya: pada tekanan yang sangat rendah dan pada suhu yang sangat tinggi.
Tekanan rendah menyebabkan volume yang ditempati oleh partikel gas dapat diabaikan dibandingkan dengan ukuran wadah, sedangkan suhu tinggi membuat partikel bergerak begitu cepat sehingga mereka tidak punya waktu untuk berinteraksi ketika mereka saling berselisih.
Dalam kondisi ini, sebagian besar gas memenuhi hukum Avogadro dengan akurasi yang baik.
Pentingnya Hukum Avogadro
Salah satu kontribusi terpenting dari hukum Avogadro adalah bahwa ia diizinkan untuk menunjukkan keberadaan gas dasar yang dibentuk oleh lebih dari satu atom sebagai o2 atau h2. Ini berkontribusi pada kemajuan teori atom.
Selain itu, hukum Avogadro melengkapi hukum Boyle, Charles dan Gay-Lussac, dan menggabungkannya dengan ketiga undang-undang ini, hukum Avogadro memungkinkan hukum gas ideal, salah satu hukum terpenting dalam kimia.
Di sisi lain, hukum Avogadro juga memungkinkan membangun hubungan antara bobot molekul dari gas yang berbeda, karena itu menyiratkan bahwa massa volume yang sama dari gas yang berbeda diukur pada suhu dan tekanan yang sama, sebanding dengan massa masing -masing partikel masing -masing gas.
Dapat melayani Anda: natrium nitrat (nano3): struktur, sifat, penggunaan, risikoJadi dengan sampel penyesalan tunggal dari dua gas yang menempati volume sama dengan suhu dan tekanan yang sama, hubungan antara massa molar dapat diperoleh.
Contoh Hukum Avogadro dalam Kehidupan Sehari -hari
Balon pesta
Kami pernah melihat badut di pesta anak -anak yang menggembungkan balon helium untuk mendistribusikannya di antara anak -anak. Balon ini berada pada suhu yang kira -kira sama. Jika dua balon pesta diisi pada tekanan yang sama dan keduanya berukuran sama, hukum Avogadro memastikan bahwa kedua balon akan memiliki jumlah mol helium yang sama.
Di sisi lain, jika salah satu balon lebih besar dari yang lain, ia akan memiliki volume yang lebih besar dan, menurut hukum Avogadro, ia akan memiliki jumlah partikel helium yang lebih besar di dalamnya.
Ban mobil
Terlepas dari gas mana yang diisi, ban di sisi yang berlawanan dari mobil selalu diisi dengan tekanan akhir yang sama sekitar 32 psi.
Selain itu, kami selalu memastikan bahwa kedua karet itu sama, sehingga mereka akan memiliki volume yang sama. Dengan demikian, menurut prinsip Avogadro, kita dapat mengatakan bahwa kedua ban akan mengandung jumlah partikel gas yang sama.
Jarum suntik penuh udara
Misalkan kita memiliki jarum suntik terbuka dan penuh 50 cm3 udara. Seperti terbuka, bagian dalam jarum suntik dan eksterior (lingkungan) berada pada suhu dan tekanan yang sama.
Sekarang misalkan kita menekan plunger jarum suntik dan memindahkannya sampai 10 cm dibaca3. Saat jarum suntik terungkap, udara keluar melalui ujung saat plunger bergerak, maka jumlah partikel udara di dalam jarum suntik berkurang seiring dengan volume.
Dapat melayani Anda: volatilisasiKarena tekanan maupun suhu tidak berubah, hukum Avogadro tidak dapat diterapkan untuk menghubungkan volume akhir dengan jumlah partikel udara yang tetap di dalam jarum suntik. Hubungan ini adalah:

Mengatur ulang persamaan ini, kami mengerti:
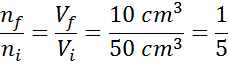
Hasil ini berarti bahwa, jika kita mengurangi volume di dalam jarum suntik ke yang kelima, menjaga konstanta P dan T, maka jumlah tahi lalat atau partikel yang ada di dalam pada akhir proses juga akan menjadi bagian kelima dari apa yang semula.


