Hukum Boyle
- 3517
- 596
- Herbert Fritsch
Apa itu Hukum Boyle?
Itu hukum Hukum Boyle atau Boyle-Maleotte Ini adalah salah satu yang mengekspresikan hubungan antara tekanan yang diberikan oleh atau pada gas, dan volume yang ditempati ini; terus menjaga suhu gas, serta kuantitasnya (jumlah mol).
Undang-undang ini, bersama dengan hukum Charles, Gay-Lussac, Charles dan Avogadro, menggambarkan perilaku gas yang ideal; Secara khusus, dalam wadah tertutup yang tunduk pada perubahan volume yang diberikan oleh gaya mekanik.
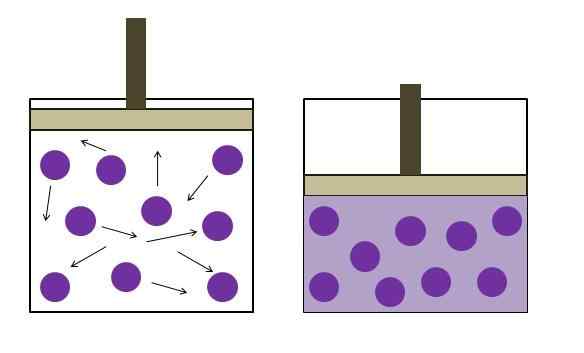
 Peningkatan tekanan pengurangan tekanan. Sumber: Gabriel Bolívar
Peningkatan tekanan pengurangan tekanan. Sumber: Gabriel Bolívar Gambar atas secara singkat merangkum hukum Boyle. Titik ungu mewakili molekul atau atom gas, yang bertabrakan dengan dinding internal wadah (kiri). Dengan mengurangi ruang atau volume wadah yang tersedia yang ditempati oleh gas ini, tabrakan meningkat, yang diterjemahkan menjadi peningkatan tekanan (kanan).
Ini menunjukkan bahwa tekanan P dan volume V dari gas berbanding terbalik jika wadah ditutup rapat; Kalau tidak, tekanan yang lebih besar akan sama dengan pelebaran wadah yang lebih besar.
Jika grafik V terhadap P, dengan data V dan P pada sumbu dan dan x, masing -masing, akan diamati, kurva asimptotik akan diamati. Semakin rendah V, semakin besar peningkatan P; Yaitu, kurva akan meluas ke nilai tinggi p pada sumbu x.
Tentu saja, suhunya tetap konstan; Tetapi, jika percobaan yang sama dilakukan pada suhu yang berbeda, posisi relatif dari kurva ini v vs p akan berubah pada sumbu cartesian. Perubahan itu akan lebih jelas jika grafik pada sumbu tiga dimensi, dengan t konstan pada sumbu z.
Sejarah Hukum Boyle
Latar belakang
Karena ilmuwan Galileo Galilei menyatakan keyakinannya pada keberadaan kekosongan (1638), para ilmuwan mulai mempelajari sifat -sifat udara dan kesenjangan parsial.
Ahli kimia AngloDandia, Robert Boyle, memulai studinya tentang properti udara pada tahun 1638 setelah mengetahui bahwa Otto von Guericke, seorang insinyur dan insinyur fisik, telah membangun bom udara.
Dapat melayani Anda: bromin: riwayat, struktur, konfigurasi elektronik, properti, penggunaanEksperimen Merkurius
Untuk melakukan studi tekanan udara, Boyle menggunakan tabung bentuk "j", yang konstruksinya dikaitkan dengan Robert Hooke, seorang asisten Boyle. Ujung lengan pendek disegel, sedangkan ujung lengan panjang tabung terbuka untuk menempatkan merkuri.
Sejak awal, Boyle ingin mempelajari elastisitas udara, secara kualitatif dan kuantitatif. Saat merkuri mengalir melalui ujung terbuka tabung dalam bentuk "j", Boyle menyimpulkan bahwa udara di lengan pendek tabung dikontrak di bawah tekanan merkuri.
Hasil
Semakin besar jumlah merkuri yang ditambahkan ke tabung, semakin besar tekanan yang diberikan pada udara dan semakin rendah volumenya. Boyle memperoleh grafik eksponensial negatif dari volume udara tergantung pada tekanannya.
Sementara itu, jika volume udara terhadap tekanan terbalik diplot, ada garis lurus kemiringan positif.
Pada tahun 1662, Boyle menerbitkan hukum fisik pertama yang diberikan dalam bentuk persamaan, yang menunjukkan ketergantungan fungsional dari dua variabel. Dalam hal ini, tekanan dan volume.
Boyle mengatakan ada hubungan terbalik antara tekanan yang diberikan pada gas dan volume menempati gas itu, hubungan yang relatif benar untuk gas nyata ini. Sebagian besar gas berperilaku sebagai gas ideal untuk tekanan dan suhu sedang.
Ketika tekanan yang lebih tinggi dan suhu yang lebih rendah terjadi, penyimpangan dari perilaku gas nyata dari cita -cita menjadi lebih terkenal.
Edme Mariotte
Fisikawan Prancis Edme Mariotte (1620-1684) secara independen menemukan hukum yang sama pada tahun 1679. Tapi dia mendapat manfaat menunjukkan bahwa volume bervariasi dengan suhu. Itulah mengapa itu disebut Hukum Mariotte atau Hukum Boyle dan Mariotte.
Memperkuat hukum
Daniel Bernoulli (1737) memperkuat hukum Boyle dengan menunjukkan bahwa tekanan gas dihasilkan oleh dampak partikel gas pada dinding wadah yang mengandungnya.
Ini dapat melayani Anda: Nukleofil: Serangan Nukleofilik, Jenis, Contoh, NukleofilisitasPada tahun 1845, John Waterston menerbitkan sebuah artikel ilmiah, yang berfokus pada prinsip -prinsip utama teori kinetik gas.
Selanjutnya, Rudolf Clausius, James Maxwell dan Ludqwig Boltzmann mengkonsolidasikan teori kinetik gas, yang menghubungkan tekanan yang diberikan oleh gas dengan kecepatan partikel gas bergerak bergerak bergerak bergerak.
Semakin rendah volume wadah yang mengandung gas, semakin besar frekuensi dampak partikel yang membentuknya di dinding wadah; Dan oleh karena itu, semakin besar tekanan yang diberikan oleh gas.
Apa hukum ini?
Eksperimen yang dilakukan oleh Boyle, menunjukkan bahwa ada hubungan terbalik antara volume yang ditempati oleh gas dan tekanan yang diberikan di atasnya. Namun, hubungan yang disebutkan di atas tidak sepenuhnya linier, seperti yang ditunjukkan oleh grafik variasi volume sesuai dengan tekanan yang dikaitkan dengan Boyle.
Dalam Hukum Boyle diindikasikan bahwa volume yang ditempati oleh gas berbanding terbalik dengan tekanan. Juga diindikasikan bahwa produk tekanan gas dengan volumenya konstan.
Ekspresi matematika
Untuk sampai ke ekspresi matematika hukum Boyle, itu dimulai dari:
V ∝ 1/p
Di mana itu menunjukkan bahwa volume yang ditempati oleh gas berbanding terbalik dengan tekanannya. Namun, ada konstanta yang menentukan seberapa berbanding terbalik hubungan ini.
V = k/p
Di mana k adalah konstanta proporsionalitas. Membersihkan k yang Anda miliki:
VP = k
Produk tekanan gas berdasarkan volumenya adalah konstan. Jadi:
V1P1 = K dan v2P2 = k
Dan ini dapat disimpulkan bahwa:
V1P1 = V2P2
Yang terakhir adalah ungkapan atau persamaan akhir untuk hukum Boyle.
Untuk apa? Masalah apa yang dipecahkan oleh hukum Boyle?
Mesin uap
Hukum Boyle-Maleotte diterapkan dalam pengoperasian mesin uap. Ini adalah mesin pembakaran eksternal yang menggunakan transformasi energi termal sejumlah air menjadi energi mekanik.
Air dipanaskan dalam boiler yang tertutup rapat, dan uap yang diproduksi memberikan tekanan sesuai dengan hukum Boyle yang menghasilkan perluasan volume silinder dengan mendorong piston.
Dapat melayani Anda: faktor pengenceranGerakan linier piston diubah menjadi gerakan rotasi, dengan menggunakan engkol dan sistem engkol, yang dapat menggerakkan roda lokomotif atau rotor generator listrik.
Minum minuman
Tindakan bercita -cita soda atau jus botol melalui tabung plastik terkait dengan hukum Boyle. Ketika udara tabung disarankan menggunakan mulut, ada penurunan tekanan di dalam tabung.
Penurunan tekanan ini memfasilitasi gerakan naik cairan dalam tabung, memungkinkan konsumsi. Prinsip yang sama ini bekerja dalam ekstraksi darah dengan menggunakan jarum suntik.
Sistem pernapasan
Hukum Boyle terkait erat dengan fungsi sistem pernapasan. Selama fase inspirasi, kontraksi diafragma dan otot -otot lainnya terjadi; Misalnya, interkostal eksternal yang menghasilkan perluasan tulang rusuk.
Ini menyebabkan penurunan tekanan intrapleural, menyebabkan ekspansi paru yang menghasilkan peningkatan volume paru -paru. Oleh karena itu, tekanan intrapulmoner berkurang sesuai dengan apa yang diangkat dalam hukum Boyle.
Dengan menjadi subatosa tekanan intrapulmoner, udara atmosfer mengalir ke paru -paru, yang menghasilkan peningkatan tekanan di paru -paru; dengan demikian mencocokkan tekanannya dengan tekanan atmosfer, dan menyimpulkan fase inspirasi.
Selanjutnya, otot -otot inspirasi rileks dan kontrak otot -otot ekspirasi. Selain itu, retraksi paru elastis diproduksi, sebuah fenomena yang menghasilkan penurunan volume paru -paru, dengan konsekuensi peningkatan tekanan intrapulmoner, dapat dijelaskan oleh hukum Boyle.
Dengan meningkatkan tekanan intrapulmoner, dan menjadi lebih besar dari tekanan atmosfer, aliran udara di dalam paru -paru ke atmosfer. Ini terjadi sampai tekanan sama dengan, yang menyimpulkan fase kedaluwarsa.
Referensi
- Hukum Boyle. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Formula untuk Hukum Boyle. Pulih dari: thinkco.com

