Hukum Henry

- 2961
- 104
- Pete Lesch
 Hukum Henry menjelaskan efervesensi minuman ringan
Hukum Henry menjelaskan efervesensi minuman ringan Apa Hukum Henry?
Itu Hukum Henry Hubunganlah yang menggambarkan efek tekanan pada kelarutan gas. Undang -undang ini menetapkan bahwa kelarutan gas yang bersentuhan dengan permukaan cairan pada suhu tertentu berbanding lurus dengan tekanan parsial gas tersebut pada cairan.
Ini berarti bahwa, semakin besar tekanan gas pada cairan, semakin besar jumlah total gas yang dapat dilarutkan di dalamnya, sehingga mendapatkan konsentrasi yang lebih besar (yaitu, semakin besar kelarutan).
Hukum Henry Kami melihatnya beraksi setiap kali kami menemukan minuman soda. Ditutup, tekanan tinggi di dalam botol membuat gas karbonik larut. Tetapi dengan mengungkapnya, tekanan gas berkurang, yang mengurangi kelarutannya dan lolos dari membentuk gelembung dan efervesensi.
Formula Hukum Henry
Dalam bentuk matematika, hukum Henry dinyatakan sebagai hukum proporsionalitas:
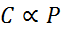
Hukum proporsionalitas ini diubah menjadi:
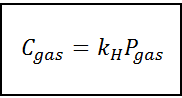
Di mana C Ini mengacu pada konsentrasi gas maksimum dalam cairan, yaitu kelarutannya; Pgas Itu adalah tekanan parsial gas yang bersentuhan dengan cairan dan kH Itu adalah konstanta proporsionalitas yang disebut Konstanta Hukum Henry.
Konsentrasi gas dapat diekspresikan dalam unit yang berbeda seperti molaritas, moleity atau fraksi molar. Namun, dalam kebanyakan kasus, bahan kimia menggunakan konsentrasi dalam unit molaritas (dalam mol/L), sedangkan tekanan dinyatakan dalam atmosfer.
Dapat melayani Anda: Anthracene: Apa itu, Struktur, Properti, PenggunaanKonstanta hukum Henry (kH)
Konstan kH Jelaskan interaksi antara gas dan pelarut. Semakin kuat interaksi ini, semakin besar konstanta dan, oleh karena itu, semakin besar kelarutan gas dalam pelarut pada suhu dan tekanan tertentu.
Secara numerik, nilai dari kH mewakili kelarutan gas pada suhu yang diberikan, ketika tekanan parsial yang sama adalah 1 atm.
Bergantung pada unit konsentrasi dan tekanan yang digunakan dalam persamaan, konstanta ini dapat memiliki unit mol/L.atm, mol/kg.atm, dll.
Tabel berikut menunjukkan nilai -nilai konstanta hukum Henry untuk beberapa gas umum dalam air pada suhu 25 ° C:

Nilai -nilai ini menurun dengan suhu, karena kelarutan gas secara umum menurun pada suhu yang lebih tinggi.
Penjelasan Hukum Henry
Hukum Henry sangat mudah dimengerti dari sudut pandang mikroskopis. Kita bisa membayangkan gas sebagai satu set partikel yang sangat kecil memantul di semua permukaan yang bermain. Ketika mereka bertabrakan dengan permukaan cairan, beberapa partikel akan memantul, sementara yang lain akan melintasi permukaan yang terperangkap (yaitu, mereka akan larut).
Hal yang sama berlaku untuk partikel gas yang larut. Mereka memantul dengan dinding wadah dan juga dapat mencapai permukaan cairan, di mana beberapa akan memantul sementara yang lain akan melintasi permukaan dan melarikan diri ke fase gas.
Saat keseimbangan tercapai, kecepatan yang digunakan gas dalam pelarut dan yang melarikan diri dari mereka adalah sama, sehingga konsentrasi tetap konstan.
Dapat melayani Anda: sifat mekanik logam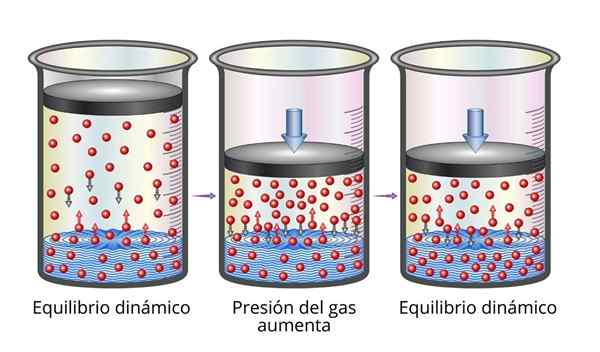 Penjelasan Hukum Henry
Penjelasan Hukum Henry Saat kita meningkatkan tekanan gas, apa yang kita lakukan adalah meningkatkan frekuensi partikel gas yang bertabrakan dengan permukaan cair. Ini membuat kecepatan yang dibubarkan gas meningkat. Ketika keseimbangan baru tercapai, konsentrasi gas yang baru akan lebih besar.
Pengecualian untuk hukum Henry
Penting untuk menyoroti bahwa hukum Henry adalah hukum yang ideal, yang hanya menggambarkan perilaku solusi gas nyata dalam kondisi tertentu. Dengan demikian, hukum Henry hanya dapat diterapkan ketika:
- Suhunya tetap konstan.
- Gas seimbang dengan solusinya.
- Tekanan gas relatif rendah.
- Gas tidak bereaksi dengan pelarut.
Terlepas dari ini, bahkan dalam beberapa kasus di mana gas bereaksi dengan pelarut, undang -undang ini dapat diterapkan kira -kira.
Contoh Penerapan Hukum Henry
Contoh 1: Penentuan konstan hukum Henry
Secara eksperimental ditentukan bahwa konsentrasi larutan berair seimbang dengan neon pada tekanan 3,00 atm dan 25 ° C adalah 0,00135 mol/L. Tentukan konstanta hukum Henry untuk neon dalam air pada suhu 25 ° C.
Larutan:
Menurut Hukum Henry:
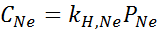
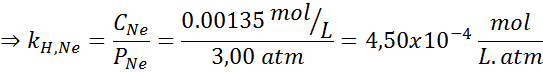
Oleh karena itu, hukum Henry konstan untuk neon dalam air pada suhu 25 ° C adalah 4,50 × 10-4 perempuan jalang.ATM.
Contoh 2: Penentuan kelarutan gas
Menggunakan konstanta hukum Henry yang diberikan dalam tabel sebelumnya, tentukan kelarutan karbon dioksida udara di air di permukaan laut, mengetahui bahwa fraksi molar gas tersebut di udara adalah 3,14 × 10-4.
Larutan:
Di permukaan laut, tekanan udara adalah 1 atm, dan tekanan parsial CO2 Itu diberikan oleh:
Itu dapat melayani Anda: asam hipoyodous (HIO)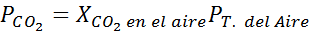
Mengganti ungkapan ini dalam hukum Henry:
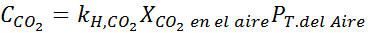
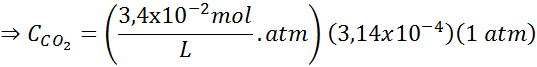
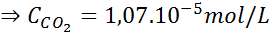
Contoh 3: Gas menyelam
Ketika seorang penyelam tidak ada di kedalaman yang lebih besar dari 30 meter, campuran udara harus bernafas dengan gas inert lainnya seperti helium atau argon, karena peningkatan konsentrasi nitrogen dalam darah yang diprediksi oleh hukum Henry memiliki efek narkotika yang menyebabkan disorientasi, kebingungan dan visi masalah.
Efek ini mulai mengamati saat menghirup udara (xN2= 0,78) pada tekanan 4,00 atm. Jika penyelam berencana untuk turun hingga 100 meter, di mana tekanannya sekitar 11,0 atm, berapa fraksi nitrogen maksimum yang dapat bernafas sebelum menderita penyelundup narkoba?
Larutan:
Berdasarkan pernyataan itu, kita dapat menyimpulkan bahwa konsentrasi maksimum nitrogen adalah apa yang terjadi ketika tekanan udara adalah 4,00 atm. Menurut hukum Henry dan menggunakan hubungan antara tekanan total dan tekanan parsial dari contoh sebelumnya:
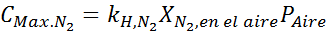
Ini harus konsentrasi maksimum yang sama pada tekanan total apa pun. Jadi, 100 meter:
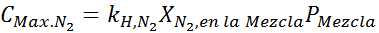
Menyamakan kedua persamaan, kita dapat menemukan fraksi molar maksimum nitrogen dalam campuran:
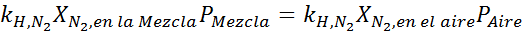
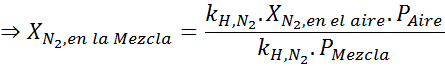
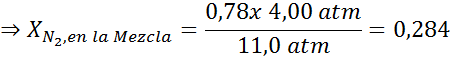
Ini berarti bahwa penyelam tidak boleh menggunakan campuran yang mengandung lebih dari 28,4% nitrogen jika berencana untuk menyelam hingga 100 meter.

