Hukum Prinsip dan Formula RAULT, Contoh, Latihan
- 4915
- 942
- Domingo Gutkowski
Itu Hukum Rauolt Ini adalah salah satu yang digunakan untuk menjelaskan keturunan atau pengurangan tekanan uap, hadir pada larutan, karena pembubaran zat terlarut yang tidak volatil, seperti garam atau senyawa organik.
Undang -undang ini juga digunakan untuk menganalisis dan menggambarkan komposisi pelarut volatil dalam fase gas, yang terletak di ruang pada larutan yang menyajikan campuran dari mereka. Hukum menyandang namanya untuk menghormati penciptanya, François-Marie Rauolt (1830-1901).
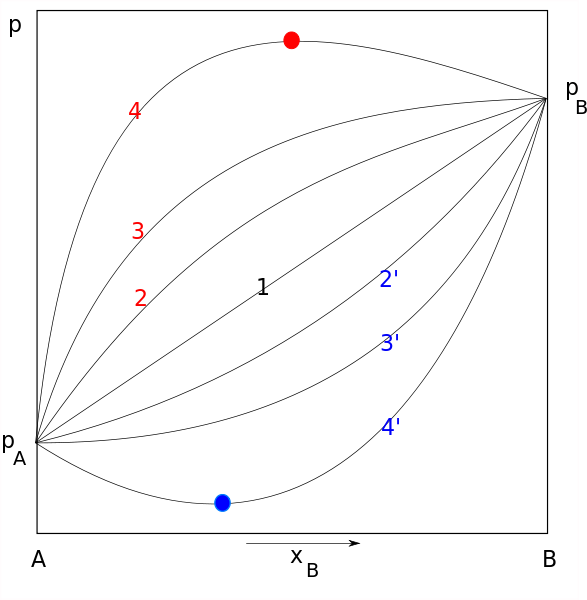
 Diagram Hukum Rault. Baris 1 mewakili perilaku yang ideal, sedangkan merah dan biru masing -masing sesuai dengan penyimpangan positif dan negatif. Sumber: Joanna Kośmider / domain publik
Diagram Hukum Rault. Baris 1 mewakili perilaku yang ideal, sedangkan merah dan biru masing -masing sesuai dengan penyimpangan positif dan negatif. Sumber: Joanna Kośmider / domain publik Hukum Rauolt berlaku untuk solusi ideal yang mematuhi beberapa karakteristik, termasuk yang berikut: kekuatan antarmolekul antara molekul yang sama (gaya kohesif) harus sama dengan kekuatan antarmolekul antara molekul yang berbeda atau berbeda (gaya perekat).
Banyak solusi tidak ideal, yang menjelaskan penyimpangan hukum Rauolt yang diamati dalam beberapa campuran pelarut yang mudah menguap. Misalnya, campuran kloroform (ch3Cl) dan aseton (pilih3Coch3), menyajikan penyimpangan negatif dari hukum Raoul.
 François-Marie Rault
François-Marie Rault Tekanan uap dalam fase gas dalam kasus seperti itu kurang dari yang diprediksi oleh hukum, dapat dijelaskan dengan pembentukan jembatan hidrogen antara komponen campuran.
[TOC]
Prinsip dan formula
Hukum Rauolt menunjukkan bahwa tekanan uap parsial yang diberikan oleh komponen yang mudah menguap atau pelarut campuran gas, di atas larutan, terkait dengan tekanan uap yang diberikan oleh komponen atau pelarut volatil murni, dan fraksi molar masing -masing masing -masing.
Dapat melayani Anda: nepelometriPersamaan berikut merangkum hal di atas:
PSv = PSvº · xSv
Dimana halSv Ini adalah tekanan parsial dari pelarut volatil dalam campuran soda, pSvº Tekanan pelarut volatil murni, dan xSv fraksi molar dalam larutan pelarut volatil.
Campuran pelarut yang mudah menguap
Jika Anda memiliki campuran dua pelarut volatil (A dan B) dalam larutan, Anda dapat menghitung tekanan uap yang berasal dari fase gas, di atas larutan. Ini akan menjadi jumlah dari tekanan parsial yang diberikan oleh gas A dan B:
PKE = XKE · PKEº
PB = XB · PBº
Jadi menambahkan tekanan A dan B kita mendapatkan tekanan P total:
P = xKE · PKEº +xB · PBº
Di mana p adalah tekanan uap campuran soda di atas larutan, xKE dan xB Fraksi molar dari pelarut volatil A dan B dalam campuran, dan pKEº dan pBº Tekanan uap dari pelarut volatil murni a dan b.
Penurunan tekanan pada fase gas karena adanya zat terlarut yang tidak volatil
Tekanan parsial pelarut volatil pada fase gas diberikan oleh ekspresi:
P = pKEº · xKE
Di hadapan A zat terlarut dalam larutan, fraksi molar B diekspresikan sebagai berikut:
XB = 1 -xKE
Kemudian, melalui pengobatan matematika sederhana, ekspresi tercapai:
ΔP = pKEº · xB (1)
Di mana ΔP adalah penurunan tekanan parsial pelarut pada fase gas.
Ekspresi matematika (1) menunjukkan penurunan tekanan uap dari pelarut karena adanya zat terlarut B yang tidak volatil. Penurunan tekanan uap pelarut telah dijelaskan karena lokasi molekul B zat terlarut pada permukaan larutan.
Ini dapat melayani Anda: Grup Karbonil: Karakteristik, Properti, Nomenklatur, ReaktivitasKehadiran molekul B zat terlarut akan menghasilkan penurunan konsentrasi molekul pelarut pada permukaan larutan, membatasi penguapannya; Dan dengan demikian menjelaskan, penurunan tekanan uap dalam fase gas.
Contoh
Hukum Rault berfungsi untuk menghitung tekanan uap dari komponen solusi yang mudah menguap, seperti etanol, benzena, toluena, etana, propana, dll., dalam ruang pada solusi.
Ini dapat digunakan untuk menghitung tekanan uap yang dihasilkan dalam ruang pada larutan, sebagai konsekuensi dari campuran cairan volatil, baik benzena dan toluena, etana dan propana, aseton dan etanol, dll.
Juga, dengan undang -undang ini Anda dapat menentukan apa yang akan menjadi penurunan tekanan uap jika, misalnya, itu akan melarutkan sukrosa di dalam air, menjadi zat terlarut yang tidak volatile.
Latihan terpecahkan
Latihan 1
Hitung tekanan uap dari larutan yang disiapkan dengan melarutkan 60 g natrium klorida (NaCl) dalam 400 g air (h2SALAH SATU). Tekanan uap air (PH2oº) A 37 ºC adalah 47,1 mmHg. Berat molekul h2O = 18 g/mol dan berat molekul NaCl = 58,5 g/mol.
Kami pertama -tama menghitung mol air dan natrium klorida untuk menentukan fraksi molar mereka:
Mol dari h2O = gram h2O / pm h2SALAH SATU
= 400 g / (18 g / mol)
= 22.22 mol
Mol NaCl = g NaCl / PM NaCl
= 60 g / (58,5 g / mol)
= 1,03 mol
NaCl adalah senyawa elektrolitik yang terdisosiasi dalam Na+ + Cl-. Oleh karena itu, 1,03 mol NaCl terdisosiasi dalam 1,03 mol Na+ dan 1,03 mol Cl-.
Itu bisa melayani Anda: reaksi maillardKami memiliki ekspresi:
Pv = XH2o · PH2oº
Karena itu kami kekurangan fraksi air molar:
XH2o = Mol dari h2O / (mol H2O +mol na+ + Mol dari cl-)
= 22.2 mol / 22.22 mol +1.03 mol +1.03 mol
= 0,896
Dan kami menghitung pv:
Pv = 47.1 mmHg · 0.896
Pv = 42.20 mmHg
Menjadi penurunan tekanan uap karena adanya natrium klorida:
ΔPv = 47.1 mmHg - 42.20 mmHg
= 4,9 mmHg
Latihan 2
Pada suhu -100 ºC etana (pilih3Ch3) dan propana (cho3Ch2Ch3) Mereka adalah cairan. Pada suhu itu, tekanan uap etana murni (pEtanoº) adalah 394 mmHg, sedangkan tekanan uap propana murni (ppropanaº) adalah 22 mmHg. Apa yang akan menjadi tekanan uap pada larutan yang mengandung jumlah yang sama dari kedua senyawa?
Pendekatan masalah menunjukkan bahwa solusinya mengandung jumlah senyawa yang sama. Ini menyiratkan bahwa fraksi molar senyawa dan senyawa propana tentu sama dengan 0,5.
Sekali lagi, solusinya datang dengan ekspresi:
Pv = PEtano + Ppropana
Kami menghitung tekanan parsial dari etana dan propana:
PEtano = PEtanoº · xEtano
= 394 mmHg · 0,5
= 197 mmHg
Ppropana = Ppropanaº · xpropana
= 22 mmHg · 0,5
= 11 mmHg
Jadi kami akhirnya menghitung pv:
Pv = PEtano + Ppropana
= 197 mmHg +11 mmHg
= 208 mmHg
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage
- Wikipedia. (2020). Hukum Rault. Diperoleh dari: di.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11 Februari 2020). Definisi Hukum Rault dalam Kimia. Pulih dari: thinkco.com
- Encyclopædia Britannica. (2020). Hukum Rault. Dipulihkan dari: Britannica.com
- Clark J., Ly i., & Khan s. (18 Mei 2020). Hukum Rault. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- « Jumlah momentum sudut, konservasi, contoh, latihan
- Konsep, karakteristik, dan contoh objek buram »

