Hukum Ritchter-Wenzel Apa, cerita, pernyataan, contoh
- 4177
- 1347
- Frederick Pfeffer
Itu Hukum Ritchter-Wenzel atau dari proporsi timbal balik adalah salah satu yang menetapkan bahwa proporsi massa antara dua senyawa memungkinkan untuk menentukan bahwa senyawa ketiga. Ini adalah salah satu hukum stoikiometri, bersama dengan hukum Lavoisier (hukum konservasi massa); Hukum Proust (hukum proporsi yang ditentukan); dan hukum Dalton (hukum proporsi berganda).
Ritcher menafsirkan hukumnya pada tahun 1792 dalam sebuah buku yang mendefinisikan fondasi stoikiometri, berdasarkan karya penelitian Carl F Wenzel, yang pada 1777 menerbitkan tabel kesetaraan pertama untuk asam dan basa.
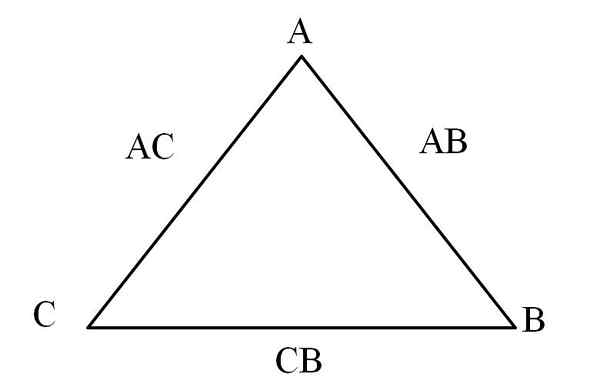
 Segitiga timbal balik. Sumber: Gabriel Bolívar
Segitiga timbal balik. Sumber: Gabriel Bolívar Cara sederhana untuk memvisualisasikannya adalah melalui "segitiga timbal balik" (gambar superior). Jika massa A, C dan B diketahui yang dicampur untuk membentuk senyawa AC dan AB, dapat ditentukan berapa banyak C dan B dicampur atau bereaksi untuk membentuk senyawa CB.
Dalam senyawa AC dan AB elemen A hadir di keduanya, jadi ketika membagi proporsi massa mereka adalah seberapa banyak C bereaksi dengan B.
[TOC]
Sejarah dan generalisasi hukum proporsi timbal balik
Richter menemukan bahwa proporsi berat senyawa yang dikonsumsi dalam reaksi kimia selalu sama.
Dalam hal ini, Ritcher menemukan bahwa 615 bagian diperlukan oleh berat magnesia (MGO), misalnya, untuk menetralkan 1000 bagian dengan berat asam sulfat.
Antara 1792 dan 1794, Ritcher menerbitkan ringkasan tiga volume yang berisi karyanya tentang hukum proporsi yang ditentukan. Ringkasan mencoba stoikiometri, mendefinisikannya sebagai seni pengukuran kimia.
Dapat melayani Anda: kromatografi lapisan halus: karakteristik, untuk apa ituMenunjuk, selain itu, bahwa stoikiometri berkaitan dengan hukum yang sesuai dengan zat mana yang bergabung untuk membentuk senyawa. Namun, karya penelitian Richter dikritik karena perlakuan matematika yang ia gunakan, mencatat bahwa ia menyesuaikan hasilnya.
Pada tahun 1802, Ernst Gottfried Fischer menerbitkan tabel pertama yang setara kimia, yang menggunakan asam sulfat dengan angka 1000; Mirip dengan nilai yang ditemukan oleh Richter, untuk netralisasi asam sulfat oleh magnesia.
Namun, telah ditunjukkan bahwa Richter membangun tabel peso kombinasi yang menunjukkan proporsi di mana sejumlah senyawa bereaksi. Misalnya, diindikasikan bahwa 859 bagian NaOH menetralkan 712 bagian HNO3.
Pernyataan dan konsekuensi
Pernyataan Hukum Richter-Wenzel adalah sebagai berikut: massa dari dua elemen berbeda yang dikombinasikan dengan jumlah yang sama dari elemen ketiga, menjaga hubungan yang sama dengan massa elemen-elemen tersebut ketika dikombinasikan satu sama lain.
Undang-undang ini memungkinkan menetapkan bobot yang setara, atau gram cukur berat badan, seperti jumlah elemen atau senyawa yang akan bereaksi dengan jumlah yang tetap dari zat referensi.
Richter disebut sebagai bobot kombinasi yang terkait dengan bobot elemen yang dikombinasikan dengan masing -masing gram hidrogen. Bobot kombinasi relatif Richter sesuai dengan apa yang saat ini dikenal sebagai berat setara dari elemen atau senyawa.
Sesuai dengan pendekatan sebelumnya, hukum Richter-Wenzel dapat dinyatakan sebagai berikut:
Bobot kombinasi dari berbagai elemen yang dikombinasikan dengan bobot tertentu dari elemen yang diberikan adalah bobot kombinasi relatif dari elemen -elemen tersebut bila dikombinasikan satu sama lain, atau kelipatan atau submultiple dari hubungan jumlah ini.
Itu dapat melayani Anda: metode pemisahan campuran heterogenContoh
Kalsium klorida
Dalam kalsium oksida (CAO), 40 g kalsium dikombinasikan dengan 16 g oksigen (O). Sementara itu, pada oksida hipoklor (CL2O), 71 g klorin dikombinasikan dengan 16 g oksigen. Senyawa apa yang akan dibentuk kalsium jika dikombinasikan dengan klorin?
Menggunakan segitiga timbal balik, oksigen adalah elemen umum untuk dua senyawa. Proporsi massa dari dua senyawa teroksigenasi ditentukan terlebih dahulu:
40g ca/16 go = 5g ca/2g atau
71g CL/16G atau
Dan sekarang membagi dua proporsi massa CAO dan CL2Atau kita akan memiliki:
(5g CA/2G O)/(71g Cl/16G O) = 80G CA/142G Cl = 40g CA/71G CL
Perhatikan bahwa hukum proporsi massa terpenuhi: 40 g kalsium bereaksi dengan 71 g klorin.
Sulfur oksida
Oksigen dan sulfur bereaksi dengan tembaga untuk memberikan tembaga (CuO) dan tembaga sulfida (CUS), masing -masing. Berapa banyak belerang akan bereaksi dengan oksigen?
Dalam tembaga oksida, 63,5 g tembaga dikombinasikan dengan 16 g oksigen. Dalam tembaga sulfida, 63,5 g tembaga bergabung pada 32 g belerang. Membagi proporsi massa yang kita miliki:
(63.5g Cu/16G O)/(63.5g Cu/32g S) = 2032G S/1016G O = 2G S/1G atau
Proporsi massa 2: 1 adalah kelipatan dari 4 (63.5/16), yang menunjukkan bahwa hukum Richter terpenuhi. Dengan proporsi ini, SO, sulfur monoksida (32 g sulfur bereaksi dengan 16 g oksigen) diperoleh.
Jika proporsi ini dibagi dua, akan ada 1: 1. Sekali lagi, sekarang 4 atau 2, dan oleh karena itu demikian2, Sulfur dioksida (32g sulfur bereaksi dengan 32 g oksigen).
Dapat melayani Anda: fucosa: karakteristik, struktur, fungsiSulfida dan oksida besi
Besi sulfida (FES) bereaksi, di mana 32 g belerang dikombinasikan dengan 56 g zat besi, dengan oksida besi (jelek), di mana 16 g oksigen dikombinasikan dengan 56 g zat besi. Elemen ini berfungsi sebagai referensi.
Dalam senyawa reaksi yang buruk, sulfur (S) dan oksigen (O) dalam kaitannya dengan zat besi (iman) ditemukan secara proporsi 2: 1. Dalam sulfurous oksida (SO) 32 g sulfur dikombinasikan dengan 16 g oksigen, sehingga sulfur dan oksigen ditemukan dalam proporsi 2: 1.
Ini menunjukkan bahwa hukum proporsi timbal balik atau hukum Richter terpenuhi.
Proporsi yang ditemukan antara sulfur dan oksigen dalam sulfur oksida (2: 1), dapat digunakan, misalnya, untuk menghitung berapa banyak oksigen yang bereaksi dengan 15 g sulfur.
o Oksigen G = (15g S) ∙ (1G O/2G S) = 7.5g
Referensi
- Hukum proporsi timbal balik: Definisi & contoh. Belajar. Pulih dari: belajar.com
- Hukum proporsi timbal balik. Libretteks Kimia. Pulih dari: chem.Librettexts.org

