Hukum Stoikiometri

- 3280
- 365
- Joseph Nader PhD
Apa itu Hukum Stoikiometri?
Hukum stoikiometri menggambarkan komposisi zat yang berbeda, berdasarkan hubungan (massa) antara masing -masing spesies yang terlibat dalam reaksi.
Semua materi yang ada dibentuk oleh kombinasi, dalam proporsi yang berbeda, dari berbagai elemen kimia yang membentuk tabel periodik. Serikat pekerja ini diatur oleh undang -undang kombinasi tertentu yang dikenal sebagai undang -undang stoikiometri atau bobot kimia.

Prinsip -prinsip ini adalah bagian mendasar dari kimia kuantitatif, sangat diperlukan untuk keseimbangan persamaan dan untuk operasi penting seperti menentukan reagen apa yang diperlukan untuk menghasilkan reaksi spesifik atau menghitung berapa banyak reagen ini diperlukan untuk mendapatkan jumlah produk yang diharapkan dari produk yang diharapkan.
Mereka dikenal luas di bidang kimia sains "keempat hukum": hukum konservasi massa, hukum proporsi yang ditentukan, hukum proporsi ganda dan hukum proporsi timbal balik.
4 Hukum Stoikiometri
Ketika diinginkan untuk menentukan cara di mana dua elemen digabungkan melalui reaksi kimia, keempat undang -undang yang dijelaskan di bawah ini harus diperhitungkan.
Hukum Konservasi Massal (atau "Hukum Konservasi Materi")
Undang -undang ini didasarkan pada prinsip bahwa materi tidak dapat dibuat atau dihancurkan, yaitu, hanya dapat diubah.
Ini berarti bahwa untuk sistem adiabatik (di mana tidak ada transfer massa atau energi dari atau ke lingkungan), jumlah materi saat ini harus terus -menerus tetap pada waktunya.
Sebagai contoh, dalam pembentukan air dari oksigen dan hidrogen gas diamati bahwa ada jumlah mol yang sama dari setiap elemen sebelum dan sesudah reaksi, sehingga jumlah total materi dipertahankan.
Dapat melayani Anda: Lapisan Valencia2h2(g) + atau2(g) → 2h2Atau (l)
-
Latihan:
P.- Menunjukkan bahwa reaksi sebelumnya memenuhi hukum konservasi massa.
R.- Pertama, ada massa molar reaktan: h2= 2 g, atau2= 32 g dan h2O = 18 g.
Kemudian, massa setiap elemen ditambahkan di setiap sisi reaksi (seimbang), dihasilkan: 2h2+SALAH SATU2 = (4+32) g = 36 g di sisi reaktan dan 2h2O = 36 g di sisi produk. Dengan demikian telah ditunjukkan bahwa persamaan tersebut sesuai dengan hukum yang disebutkan di atas.
Hukum proporsi yang ditentukan (atau "Hukum Proporsi Konstan")
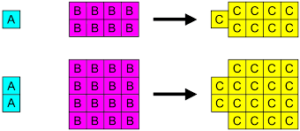
Ini didasarkan pada fakta bahwa setiap bahan kimia terbentuk dari kombinasi elemen konstituennya dalam hubungan massa yang ditentukan atau tetap, yang unik untuk setiap senyawa.
Contoh air, yang komposisinya dalam keadaan murni akan selalu 1 mol O2 (32g) dan 2 mol H2 (4G). Jika pembagi umum maksimum diterapkan, ditemukan bahwa mol H bereaksi2 untuk setiap 8 mol atau2 Atau, apa yang sama, mereka bergabung dengan alasan 1: 8.
-
Latihan:
P.- Ada mol asam klorida (HCl) dan Anda ingin tahu berapa persen masing -masing komponennya.
R.- Diketahui bahwa alasan penyatuan elemen -elemen ini dalam spesies ini adalah 1: 1. Dan massa molar senyawa sekitar 36,45 g. Dengan cara yang sama, diketahui bahwa massa molar klorin adalah 35,45 g dan hidrogen adalah 1 g.
Untuk menghitung persentase komposisi masing -masing elemen, massa molar elemen dibagi (dikalikan dengan jumlah mol dalam satu mol senyawa) antara massa senyawa dan hasil ini dikalikan dengan seratus.
Dapat melayani Anda: pencairan: konsep, gas, tanah dan seismik, seminalJadi: %h = [(1 × 1) g/36.45g] x 100 = 2,74 %
Y %cl = [(1 × 35.45) g/36.45g] x 100 = 97.26 %
Dari sini disimpulkan bahwa, terlepas dari dari mana HCL berasal, dalam keadaan murni itu akan selalu dibentuk oleh 2,74% hidrogen dan 97,26% klorin.
Hukum banyak proporsi
Menurut undang -undang ini, jika ada kombinasi antara dua elemen untuk menghasilkan lebih dari satu senyawa, maka massa salah satu elemen bergabung dengan massa yang tidak berubah -ubah dari yang lain, mempertahankan hubungan yang dimanifestasikan melalui jumlah kecil.
Dioksida dan karbon monoksida diberikan sebagai contoh, yang merupakan dua zat yang dibentuk oleh elemen yang sama, tetapi dalam dioksida mereka terkait sebagai O/C = 2: 1 (untuk setiap atom C ada dua O) dan di dalam Monoksida Hubungannya adalah 1: 1.
-
Latihan:
P.- Anda memiliki lima oksida berbeda yang dapat stabil stabil menggabungkan oksigen dan nitrogen (n2Atau, tidak, n2SALAH SATU3, N2SALAH SATU4 dan N2SALAH SATU5).
R.- Diamati bahwa oksigen di setiap senyawa meningkat, dan bahwa dengan proporsi nitrogen yang tetap (28 g) ada rasio 16, 32 (16 × 2), 48 (16 × 3), 64 (16 × 4) dan masing -masing 80 (16 × 5) g oksigen; yaitu, ada alasan sederhana 1, 2, 3, 4 dan 5 bagian.
Hukum proporsi timbal balik (atau "hukum proporsi yang setara")
Ini didasarkan pada hubungan antara proporsi di mana elemen digabungkan dalam senyawa yang berbeda dengan elemen yang berbeda.
Dengan kata lain, jika suatu spesies A bergabung dengan spesies B, tetapi juga dikombinasikan dengan C; Itu haruslah bahwa elemen B dan C bergabung, hubungan massa ini sesuai dengan massa masing -masing ketika mereka bergabung secara khusus dengan massa tetap dari elemen a.
-
Latihan:
P.- Jika Anda memiliki 12g C dan 64G S untuk membentuk CS2, Selain itu ada 12g C dan 32G O To Origining CO2 dan akhirnya 10g S dan 10g O untuk memproduksinya2. Bagaimana prinsip proporsi yang setara dapat diilustrasikan?
Itu dapat melayani Anda: asam hypoclorous (hclo): struktur, sifat, penggunaan, sintesisR.- Proporsi massa sulfur dan oksigen dalam kombinasi dengan adonan karbon yang ditentukan sama dengan 64:32, yaitu 2: 1. Kemudian, proporsi sulfur dan oksigen adalah 10:10 saat bergabung secara langsung atau, apa yang sama, 1: 1. Jadi kedua hubungan itu merupakan kelipatan sederhana dari masing -masing spesies.
Referensi
- Wikipedia. (S.F.). Stoikiometri. Diterima dari.Wikipedia.org.
- Chang, R. (2007). Kimia, Edisi Kesembilan (McGraw-Hill).
- Muda, s. M., Vining, W. J., Hari, r., dan kerusakan, b. (2017). (Kimia Umum: Atom Pertama. Pulih dari buku.Google.bersama.pergi.
- Szabadváry, f. (2016). Sejarah Kimia Analitik: Seri Internasional Monograf dalam Kimia Analitik. Pulih dari buku.Google.bersama.pergi.
- Khanna, s. K., Verma, n. K., Dan kapila, b. (2006). Unggul dengan pertanyaan objektif dalam kimia. Pulih dari buku.Google.bersama.pergi.

