Alkali Logam Sifat Fisik dan Kimia, Penggunaan, Memperoleh
- 962
- 252
- Miss Wm Hudson
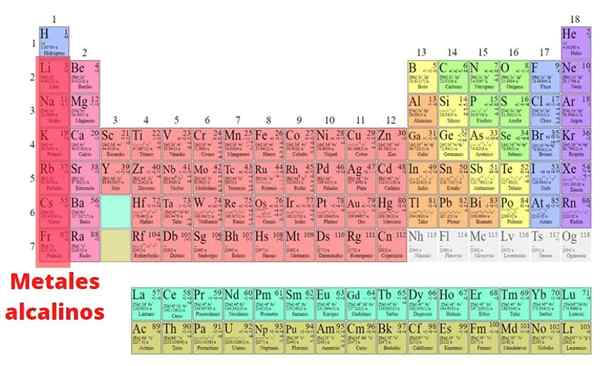
Itu Logam Alkali Ini adalah elemen yang merupakan bagian dari kelompok I dari tabel periodik, kecuali hidrogen: lithium (Li), natrium (Na), kalium (k), rubidid. Tidak seperti kebanyakan logam, mereka memiliki kepadatan rendah dan sangat reaktif. Karena reaktivitas kimia yang hebat ini, mereka tidak pernah ditemukan di alam dalam bentuk dasar mereka.
Logam -logam ini membentuk senyawa ionik sederhana dan stabil yang, sebagian besar, larut dalam air; Logam alkali biasanya dikombinasikan dengan ion halogenida, sulfat, karbonat dan silikat. Namun, beberapa elemen membentuk sejumlah senyawa kompleks dan organomethalic terbatas.

Secara umum, sifat fisik dan kimia logam alkali telah dipelajari dengan baik, kecuali untuk Francio karena sifat radioaktifnya.
[TOC]
Properti fisik
- Logam alkali adalah perak, kecuali cesium, yang merupakan emas. Mereka menghantarkan listrik dan panas, dan memiliki titik leleh rendah yang juga berkurang dengan peningkatan jumlah atom, karena hubungan antara atom melemah dengan meningkatkan jari -jari atom.
- Fakta hanya memiliki satu elektron valencia oleh atom juga membuat ikatan logamnya lemah. Akibatnya, logam alkali juga cukup lunak untuk memotongnya dengan pisau atau spatula.
- Semua elemen mengadopsi struktur kubik yang berpusat pada tubuh. Karena jenis struktur kristal ini tidak dikemas dan radio atom logam alkali besar, mereka memiliki kepadatan rendah dibandingkan dengan logam lainnya. Faktanya, lithium, natrium dan kalium mengapung dalam air.
- Perbedaan energi antara orbital lapisan valencia logam alkali bertepatan dengan panjang gelombang cahaya yang terlihat. Karena itu, saat memanaskan senyawa yang dibentuk oleh logam -logam ini dalam api, warna karakteristik dihasilkan.
Itu dapat melayani Anda: trinitrotolueno (TNT): struktur, sifat, penggunaan, risiko, ledakan- Dalam urutan menurun, garam lithium memberikan warna merah tua, garam natrium warna kuning, kalium warna ungu, rubidium warna merah kebiruan dan berhenti warna biru.
Sifat kimia
Semua logam alkali memiliki kesamaan dalam sifat kimianya.
- Mereka memiliki konfigurasi elektronik Valencia NS1, yang diterjemahkan menjadi keadaan oksidasi +1. Pada gilirannya, ini berarti bahwa mereka dengan mudah kehilangan elektron untuk mencapai konfigurasi gas mulia.
- Secara umum, logam alkali memiliki energi ionisasi terendah dari semua elemen, yang juga menurun karena jari -jari atom meningkat dalam kelompok karena lapisan valencia semakin jauh dari nukleus. Ini menjelaskan reaktivitas logam alkali dan pembentukan ion M+ dalam kondisi yang mudah berair.
- Kecenderungan termodinamika untuk membentuk ion M+ dikonfirmasi oleh potensi standar pasangan M+/M, yang semuanya besar dan negatif. Tren seperti itu menyiratkan bahwa logam basa teroksidasi dengan mudah dan dapat bertindak sebagai agen pereduksi yang kuat.
- Elemen -elemen ini harus disimpan dalam minyak non -reaktif untuk menghindari reaksi dengan oksigen atmosfer. Meskipun lithium, natrium dan kalium dapat dimanipulasi di udara untuk waktu yang singkat, rubidium dan cesium harus ditangani di bawah atmosfer lembam setiap saat.
Mendapatkan logam alkali
Sodium

Cara terbaik untuk mendapatkan natrium logam melibatkan elektrolisis natrium klorida cair. Karena titik leleh natrium klorida cukup tinggi (808 ° C) dan banyak energi diperlukan untuk mempertahankan sejumlah besar zat cair, kalsium klorida (CaCl2) biasanya ditambahkan untuk mengurangi titik leleh menjadi sekitar 600 ° C.
Dapat melayani Anda: turbidimetriSodium diperoleh dalam keadaan cair dalam katoda dengan kemurnian 99,95% di bawah atmosfer lembam.
Lithium dan kalium
Lithium juga dapat diperoleh dari klorida yang dilemparkan dengan elektrolisis, tetapi bukan kasus kalium karena terlalu larut dalam klorida (KCL) dan tidak mengapung di permukaan sel. Selain itu, mudah menguap ke suhu operasi, sehingga menciptakan kondisi berbahaya.
Oleh karena itu, kalium diperoleh dengan mengurangi kcl cair dengan natrium cair. Sodium yang ada dalam kalium dihilangkan dengan mengkondensasi uap pada 892 ° C dan melakukan distilasi fraksional logam cair.
Rubidio dan Cesio
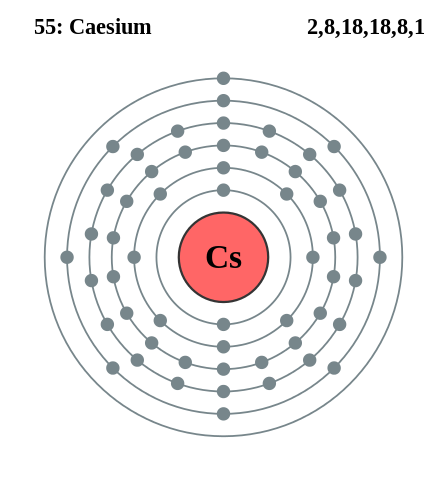 Konfigurasi Cesium Elektronik. Sumber: Pumbaa (karya asli oleh Greg Robson) / CC BY-SA 2.0 UK (https: // CreativeCommons.Org/lisensi/by-sa/2.0/Inggris/Perbuatan.di dalam)
Konfigurasi Cesium Elektronik. Sumber: Pumbaa (karya asli oleh Greg Robson) / CC BY-SA 2.0 UK (https: // CreativeCommons.Org/lisensi/by-sa/2.0/Inggris/Perbuatan.di dalam) Rubidio dan cesium dapat diperoleh dengan cara yang sama, tetapi menggunakan kalsium sebagai zat pereduksi. Cessium logam juga dapat diperoleh dengan cair cesium sianida elektrolisis (CSCN).
Penggunaan dan Aplikasi Utama
Natrium sebagai zat pereduksi
Karena natrium sangat mudah teroksidasi, aplikasinya yang paling penting adalah sebagai agen pereduksi untuk mendapatkan logam seperti titanium, surround dan hafnio. Ini juga digunakan sebagai penukar panas dalam reaktor nuklir dalam keadaan cairnya.
Kalium sebagai pupuk
 Kalium klorida, pupuk. Sumber: Abbas cucaniensis/cc by-SA (https: // createveCommons.Org/lisensi/by-sa/4.0)
Kalium klorida, pupuk. Sumber: Abbas cucaniensis/cc by-SA (https: // createveCommons.Org/lisensi/by-sa/4.0) Sebagian besar kalium yang diproses pergi ke pupuk dalam bentuk kalium klorida. Pada gilirannya, klorida digunakan dalam produksi senyawa dan larutan lain seperti kalium hidroksida, yang digunakan dalam pembuatan sabun cair.
Kalium sianida digunakan untuk ekstraksi logam atau lapisan untuk memfasilitasi deposisi tembaga, perak dan emas. Kalium juga dapat ditemukan di beberapa bahan peledak dan sebagai pewarna kembang api.
Dapat melayani Anda: Radio: Struktur, Properti, Penggunaan, MemperolehLithium sebagai agen paduan
Lithium logam digunakan sebagai agen paduan dalam produksi paduan aluminium dan magnesium aeronautika dan kedirgantaraan. Tetapi dengan berlalunya waktu, ia telah menemukan peningkatan utilitas sebagai anoda baterai basa.
Lithium logam juga memungkinkan untuk mengurangi suhu peleburan dan sintering dari jenis kaca dan keramik tertentu, selain mengurangi koefisien ekspansi. Lithium karbonat banyak digunakan untuk mengobati kondisi bipolar, sedangkan lithium stearate adalah pelumas yang banyak digunakan dalam industri otomotif.
Rubidio dan Cesio
Rubidio dan cesium biasanya digunakan dalam aplikasi yang sama, sehingga salah satu elemen ini dapat diganti dengan yang lain. Aplikasi termasuk kaca serat optik dalam industri telekomunikasi, peralatan penglihatan malam dan sel fotolektrik. Jam Cesio (jam atom) digunakan untuk ukuran waktu standar internasional dan untuk definisi yang kedua.
Referensi
- Chang, R., & Goldsby, K. KE. (2016). Kimia (edisi ke -12.). New York: MC-Graw Hill.
- Halka, m., & Nordstrom, b. (2010). Logam Bumi Alkali dan Alkali. New York: Penerbitan Infobase.
- Miesler, g. L., Fischer, hlm. J., & Tarr, D. KE. (2014). Kimia Anorganik (edisi ke -5.). New York: Pearson.
- Mishra, b., & Majumdar, G. (2017). Produksi Logam Alkali (Li, Na, K). Modul Referensi dalam Ilmu Bahan dan Rekayasa Bahan. Elsevier.
- Petrucci, r. H., Herring, f. G., Bissonnette, c., & Dewasa, j. D. (2017). Kimia Umum: Prinsip dan Aplikasi Modern (edisi ke -11.). New York: Pearson.
- Shriver, d., Weller, m., Overton, t., Rourke, J., & Armstrong, F. (2014). Kimia Anorganik (edisi ke -6.). New York: W. H. Warga kehormatan.
- « Di benua mana ada konsentrasi populasi yang lebih besar?
- Karakteristik Zaman Perunggu, Periode, Alat dan Penemuan »

