Model atom saat ini

- 3354
- 875
- Tommie Smith
Apa model atom saat ini?
Dia Model atom saat ini Ini adalah orang yang didasarkan pada mekanika kuantum, khususnya dalam persamaan Schrödinger, dalam prinsip pengecualian Pauli dan properti elektron yang disebut putaran salah satu Espin.
Ini adalah model penerimaan dan penggunaan terbesar dalam studi tentang struktur atom, molekul dan dalam reaktivitas kimia unsur -unsur, karena ketepatan prediksi mereka dan kesederhanaan relatifnya.
 Gambar 1. Atom hidrogen dalam keadaan tereksitasi dan bilangan atomnya: energi n = 4, momentum sudut l = 3 dan momen magnetik m = 1. Sumber: Wikimedia Commons.
Gambar 1. Atom hidrogen dalam keadaan tereksitasi dan bilangan atomnya: energi n = 4, momentum sudut l = 3 dan momen magnetik m = 1. Sumber: Wikimedia Commons. Model ini adalah evolusi dari beberapa model atom sebelumnya, seperti model Rutherford dan bohr - sommerfeld, dianggap sebagai model klasik atau semi -klasik.
Saat ini ada model yang lebih lengkap secara teoritis daripada model tipikal Schrödinger, seperti model Dirac-Jordan, yang menggabungkan relativitas khusus dan didasarkan pada persamaan gelombang Dirac. Dalam persamaan ini putaran, sifat elektron yang disebutkan di awal, muncul secara alami.
Ada juga model berdasarkan teori medan kuantum, diterapkan dalam fisika energi tinggi. Model -model ini sangat baik dalam prediksi penciptaan dan pemusnahan partikel fundamental, tujuan bidang fisika ini.
Perlu disebutkan bahwa teori yang paling canggih bertemu dengan hasil yang sama dengan persamaan Schrödinger, terutama untuk atom ringan.
Karakteristik model atom saat ini
Dalam visi atom saat ini, berdasarkan kuantum non-relativis, tidak ada konsep orbit elektronik dalam gaya sistem planet.
Namun, gambar atom yang paling luas masih merupakan nukleus sentral positif dan beberapa titik muatan listrik negatif (elektron), berbalik dalam orbit yang ditentukan dengan sempurna di sekitar nukleus pusat. Namun terlepas dari akarnya, ia tidak lagi sesuai dengan model atom saat ini.
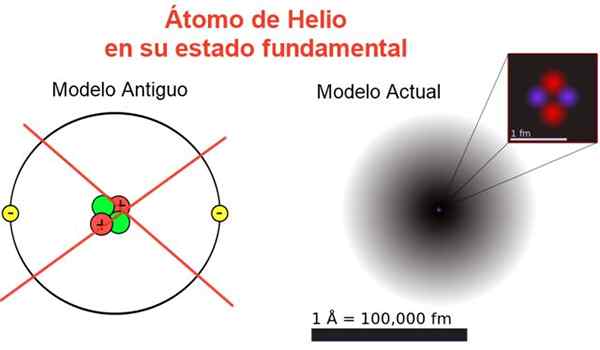 Gambar 2. Citra klasik dan saat ini dari atom helium dalam keadaan fundamentalnya. Dalam model saat ini, dua elektron atom helium tersebar di daerah yang disebut orbital. Sumber: Wikimedia Commons, komposisi Anda sendiri.
Gambar 2. Citra klasik dan saat ini dari atom helium dalam keadaan fundamentalnya. Dalam model saat ini, dua elektron atom helium tersebar di daerah yang disebut orbital. Sumber: Wikimedia Commons, komposisi Anda sendiri. Gambar 2 menunjukkan gambar lama dan gambar saat ini dari atom helium dalam keadaan energi yang lebih kecil (level n = 1 dan l = 0).
Itu dapat melayani Anda: percepatan rata -rata: bagaimana itu dihitung dan dipecahkanGambar klasik berguna untuk melihat bahwa nukleus mengandung dua proton dan dua neutron. Menjamin netralitas atom ada dua elektron yang menempati tingkat energi yang sama.
Dari sisanya adalah gambar yang jauh dari kenyataan, karena skala nukleus bahkan tidak sesuai dengan atom: inti adalah 1/100000 kali ukuran atom, tetapi di situlah massa atom terkonsentrasi.
ONDA DUALITY - Partikel
Mekanika klasik menetapkan bahwa setiap partikel material memiliki gelombang terkait, yang disebut Fungsi gelombang. Ini yang terkenal Dualitas onda-partikel dari Louis de Broglie.
Dalam model atom saat ini, perilaku elektron pada skala atom sangat bergelombang, sedangkan pada tingkat makroskopik, seperti elektron yang bergerak dalam tabung sinar katoda dari televisi lama, perilaku selnya mendominasi dominasi.
Di sisi lain, dengan foton, itu terjadi sebaliknya, di sebagian besar fenomena optik (pada tingkat makroskopis) mereka memiliki perilaku yang secara fundamental merepotkan. Dan ketika mereka berinteraksi dengan masalah materi, mereka memiliki perilaku partikel.
Karena itu, elektron di sekitar nukleus tersebar ke daerah yang disebut Orbital Atom, Bentuk dan ekstensi yang akan tergantung pada tingkat energi elektron dan momentum sudut.
Energi dan momentum sudut elektron di sekitar nukleus memiliki nilai yang diizinkan, oleh karena itu dikatakan bahwa mereka terkuantisasi.
Persamaan gelombang Schrödinger memprediksi nilai energi dan momentum sudut yang diizinkan, serta fungsi gelombang yang terkait dengan masing -masing energi dan tingkat momentum.
Kuadrat matematika dari fungsi gelombang menentukan orbital, yaitu area di sekitar nukleus di mana elektron dapat ditemukan lebih mungkin.
Ukuran atom
Untuk memiliki gambar skala dari model atom saat ini, mari kita bayangkan bahwa atom memiliki diameter seperti itu dari lapangan sepak bola. Nukleus akan seperti semut di tengah lapangan, tetapi secara mengejutkan dengan 99,9% dari massa atom.
Di sisi lain, elektron akan menjadi pemain hantu di seluruh lapangan, dengan probabilitas yang lebih besar ditemukan di lini tengah.
Dapat melayani Anda: variabel kategori: karakteristik dan contohAda beberapa keberpihakan atau diizinkan cara untuk menempati lapangan, yang bergantung pada energi para pemain (elektron) dan jumlah "belokan" atau berputar di sekitar tengah.
Model atom saat ini mendalilkan
1.- Elektron ditandai dengan massanya, dengan putarannya S Dan untuk menjadi partikel pembawa beban negatif dasar (-e).
2.- Elektron memiliki perilaku ganda berbentuk gelombang, tetapi tergantung pada energi mereka dan skala fenomena bisa lebih dominan daripada yang lain.
3.- Elektron mengelilingi nukleus atom positif, sehingga mereka menjamin netralitas listrik atom. Oleh karena itu, jumlah elektron sama dengan proton; Ini adalah nomor atom, yang memberikan karakteristik kimia dan fisik dari setiap elemen.
4.- Interaksi antara elektron dan nukleus dimodelkan oleh potensi V (R) Elektrostatik Coulomb, yang dimasukkan dalam istilah energi potensial dalam operator Hamiltonian.
5.- Istilah energi kinetik di operator Hamiltonian adalah operator yang dibangun dari operator momentum linier, menjadi sama:
P = - i ħ ∂ /∂R
Di mana ħ adalah konstanta Planck dibagi dengan 2π.
6.- Operator Hamiltonian h = (P⋅p)/2m - E V (R) bertindak pada fungsi gelombang elektron ψ (R).
7.- Karena solusi stasioner dari fungsi gelombang elektronik dicari, persamaan waktu Schrödinger yang independen digunakan:
H ψ (R) = E ψ (R)
Di mana e mewakili energi total elektron.
8.- Dalam atom dengan beberapa elektron interaksi di antara mereka tidak diperhitungkan.
9.- Ketika datang ke atom banyak elektron, orbital elektron terluar dimodelkan oleh potensi nukleus terlindung oleh elektron paling internal, yang dikenal sebagai potensi Debye.
10.- Persamaan (7) memiliki solusi untuk beberapa nilai energi diskrit, sehingga selebriti Berapa banyak dari Planck, Mereka secara alami muncul dari solusi persamaan Schrödinger.
Ini dapat melayani Anda: Gelombang Stasioner: Rumus, Karakteristik, Jenis, Contohsebelas.- Untuk setiap nilai diskrit ada fungsi gelombang. Tetapi beberapa solusi mengalami kemunduran, tergantung pada nilai momentum sudut l.
12.- Fungsi gelombang adalah produk dari fungsi radial, fungsi azimutal dan fungsi kutub.
13.- Fungsi gelombang ini menentukan daerah yang diizinkan untuk elektron. Kuadrat fungsi gelombang adalah kepadatan probabilitas untuk menemukan elektron dalam posisi tertentu, terlihat dari pusat nukleus atom.
14.- Putaran tidak muncul dalam persamaan Schrödinger, tetapi dimasukkan ke dalam model atom melalui prinsip Pauli:
Elektron adalah fermion dengan dua kemungkinan status spin +½ dan -½.
Jadi keadaan yang sama ditandai dengan angka kuantum n, l, m dari persamaan Schrödinger, dapat ditempati paling banyak dengan 2 elektron dengan lawan yang berlawanan lawan. Dengan cara ini espin menjadi angka kuantum keempat.
Ilmuwan berpengaruh dalam model atom saat ini
Tampaknya luar biasa, tetapi sebagian besar fisikawan yang berkontribusi pada model atom saat ini muncul di foto yang sama. Mereka berkumpul di konferensi terkenal yang disponsori oleh Ernest Solvay, seorang ahli kimia dan industri asal Belgia, yang menjadi terkenal di dunia sains.
Mereka mulai diadakan sejak 1911 dan menyatukan para ilmuwan terhebat saat itu, di antara mereka praktis semua orang yang memberikan kontribusi mereka pada model atom saat ini.
Konferensi paling terkenal ini diadakan di Brussels pada tahun 1927 dan di sana foto sejarah ini diambil:
 Gambar 3. 1927 Peserta Konferensi Solvay di Brussels. Sumber: Wikimedia Commons.
Gambar 3. 1927 Peserta Konferensi Solvay di Brussels. Sumber: Wikimedia Commons.  Gambar 4. Peserta Konferensi Solvay 1927.
Gambar 4. Peserta Konferensi Solvay 1927. - Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antoon Lorentz
- DONDER THéophile
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Temile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max Born
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Billouin
- Niels Bohr
- Owen Williams Richardson
Artikel yang menarik
Model Atom Schrödinger.
Model Atom Broglie.
Model Atom Chadwick.
Model Atom Heisenberg.
Model Atom Perrin.
Model Atom Thomson.
Model Atom Dalton.
Dirac Jordan Atomic Model.
Model Atom Demokritus.
Model Atom Leucipo.
Model Atom Bohr.
Referensi
- Alonso - Finn. Kuantum dan yayasan statistik. Addison Wesley.
- Bauer, w. 2011. Fisika untuk Teknik dan Ilmu Pengetahuan. Volume 1. MC Graw Hill.
- Eisberg dan Resnick. Fisika kuantum. Limusa - Wiley.
- Wikipedia. Teori atom. Pulih dari: is.Wikipedia.com
- Zapata f. Model atom tipik. Diperoleh dari: Lifer.com

